Sepsise ja septilise šoki ravijuhend - esmane diagnostika ja ravivõtted (ajakohastatud)
Siinne ravijuhend on 2018. aastal valminud ravijuhendi „Sepsise ja septilise šoki ravijuhend – esmane diagnostika ja ravivõtted“ ajakohastatud versioon.Ravijuhendi koostajad
Ravijuhendi töörühma liikmed (2024)
Ravijuhendi sekretariaadi liikmed (2024)
Ravijuhendi metoodiline tugi (2024)
Ravijuhendi töörühma liikmed (2018)
Ravijuhendi sekretariaadi liikmed (2018)
Ravijuhendi metoodiline tugi (2018)
| Joel Starkopf (juht) | Anestesioloog-intensiivraviarst, SA Tartu Ülikooli Kliinikum; anestesioloogia ja intensiivravi professor, Tartu Ülikool |
| Kadri Tamme | Anestesioloog-intensiivraviarst, SA Tartu Ülikooli Kliinikum; anestesioloogia ja intensiivravi lektor, Tartu Ülikool |
| Kairi Marie Riigor | Anestesioloog-intensiivraviarst, SA Põhja-Eesti Regionaalhaigla |
| Katri Kalju | Sisearst, AS Ida-Tallinna Keskhaigla |
| Mait Altmets | Infektsioonhaiguste arst, SA Põhja-Eesti Regionaalhaigla |
| Merike Rahkema | Erakorralise meditsiini arst, SA Põhja-Eesti Regionaalhaigla |
| Aile Kaasik | Erakorralise meditsiini arst, SA Põhja-Eesti Regionaalhaigla |
| Kersti Naelapää | Intensiivraviõde, õenduskvaliteedi peaspetsialist, SA Põhja-Eesti Regionaalhaigla |
| Johan Koort | Erakorralise meditsiini õde, Tallinna Kiirabi |
Ravijuhendi sekretariaadi liikmed (2024)
| Liisa Saare (juht) | Ravijuhendite metoodikanõunik, Tartu Ülikool |
| Triinu Keskpaik | Erakorralise meditsiini arst, SA Tartu Ülikooli Kliinikum, SA Põhja-Eesti Regionaalhaigla; erakorralise meditsiini assistent, Tartu Ülikool |
| Karl Kiisk | Anestesioloog-intensiivraviarst, SA Tartu Ülikooli Kliinikum |
| Bruno Saar | Infektsioonhaiguste arst, SA Tartu Ülikooli Kliinikum |
Ravijuhendi metoodiline tugi (2024)
| Liisa Saare | Ravijuhendite metoodikanõunik, Tartu Ülikool |
Ravijuhendi töörühma liikmed (2018)
| Joel Starkopf (juht) | Kliiniku juhataja, SA Tartu Ülikooli Kliinikum; anestesioloogia ja intensiivravi professor, Tartu Ülikool |
| Agnes Aart | Ravijuht, anestesioloog, Lõuna-Eesti Haigla AS |
| Katri Kalju | Sisearst, AS Ida-Tallinna Keskhaigla |
| Inga Karu | Anestesioloog-vanemarst, SA Põhja-Eesti Regionaalhaigla |
| Keili Kõlves | Peaspetsialist, Eesti Haigekassa |
| Pille Märtin | Infektsioonhaiguste arst, AS Lääne-Tallinna Keskhaigla |
| Merike Rahkema | Erakorralise meditsiini arst, SA Põhja-Eesti Regionaalhaigla |
| Eneli Rosin | Intensiivraviõde, SATartu Ülikooli Kliinikum; erakorralise meditsiini õde, SATartu Kiirabi |
| Kadri Tamme | Intensiivraviarst, SATartu Ülikooli Kliinikum |
Ravijuhendi sekretariaadi liikmed (2018)
| Triinu Keskpaik (juht) | Erakorralise meditsiini arst, SA Tartu Ülikooli Kliinikum, SA Põhja-Eesti Regionaalhaigla, SA Pärnu Haigla |
| Hans-Erik Ehrlich | Anestesioloogia ja intensiivravi arst-resident, SA Tartu Ülikooli Kliinikum |
| Liivi Maddison | Anestesioloog ja intensiivraviarst, SA Tartu Ülikooli Kliinikum |
| Piret Mitt | Infektsioonhaiguste arst, SA Tartu Ülikooli Kliinikum |
| Simo Saarniit | Üldkirurg, SA Tartu Ülikooli Kliinikum |
| Ergo Õkva | Anestesioloog ja intensiivraviarst, SA Tartu Ülikooli Kliinikum, AS Rakvere Haigla |
Ravijuhendi metoodiline tugi (2018)
| Kaja-Triin Laisaar | MD, MPH (epidemioloogia), PhD (arstiteadus), epidemioloogia teadur, Tartu Ülikooli peremeditsiini ja rahvatervishoiu instituut |
| Mare Oder | Peaspetsialist, Eesti Haigekassa |
Lühendid ja mõisted
Lühendid
| AGREE | Ravijuhendite hindamise tööriist, ingl appraisal of guidelines for research and evaluation instrument |
| ACCP | American College of Chest Physicians |
| ARDS | Äge respiratoorse distressi sündroom, ingl acute respiratory distress syndrome |
| CI | Usaldusvahemik, ingl confidence interval |
| CVP | Tsentraalvenoosne rõhk, ingl central venous pressure |
| EGDT | Varajane eesmärgistatud ravi, ingl early goal directed therapy |
| EM | Erakorraline meditsiin |
| ERCP | Endoskoopiline retrograadne kolangiopankreatograafia |
| ESICM | European Society of Intensive Care Medicine |
| GKS | Glasgow’ koomaskaala |
| GRADE | Soovituste määramise, hindamise ja koostamise liigitussüsteem, ingl grading of recommendations assessment, development and evaluation |
| GRADEpro GDT | Ravijuhendi veebipõhine tarkvara, ingl GRADEpro guideline development tool |
| HCT | Hematokrit |
| HR | Riskitiheduse suhe, ingl hazard ratio |
| KKV | Kopsude kunstlik ventilatsioon |
| LODS | Logistic Organ Dysfunction Score |
| MAP | Keskmine arteriaalne vererõhk, ingl mean arterial pressure |
| NEWS | National Early Warning Score |
| NICE | Ühendkuningriigi Riiklik Tervishoiu ja Kliinilise Kvaliteedi Instituut, ingl National Institute for Health and Care Excellence |
| OR | Šansside suhe, ingl odds ratio |
| PICO | Patsient-sihtrühm-sekkumine-võrdlus-tulemusnäitaja, ingl problem/population, intervention, comparison, outcome |
| RETTS | Rapid Emergency Triage and Treatment System |
| RCT | Juhuslikustatud kontrolluuring, ingl randomized controlled trial |
| RJNK | Ravijuhendite Nõukoda |
| ROC | Receiver operating characteristic curve |
| RR | Suhteline risk, ingl relative risk |
| SCCM | Society of Critical Care Medicine |
| SIRS | Süsteemne põletikureaktsioon, ingl systemic inflammatory response syndrome |
| SOFA | Sequential (Sepsis-related) Organ Failure Assessment |
| SoKo | Soovituse kokkuvõte |
| ScvO2 | Tsentraalvenoosne saturatsioon |
| qSOFA | quick SOFA |
| TõKo | Tõenduse kokkuvõte |
| WBC | Leukotsüüdid, ingl white blood count |
Mõisted
| Boolus | Infusiooniboolus on kuni 30 minuti jooksul veeni manustatud vedelik |
| Eelkoormuse dünaamiline parameeter | Eelkoormuse dünaamilise parameetriga hinnatakse mõne hemodünaamika parameetri (nt südame löögimahu või südame minutimahu) lühikese aja jooksul toimunud muutust, mis on põhjustatud rindkeresisese rõhu muutustest kopsude kunstlikul ventilatsioonil patsiendil või venoosse naasu suurenemisest jalgade passiivsel tõstmisel |
| Eelkoormuse staatiline parameeter | Eelkoormuse staatiline parameeter on ühes ajahetkes mõõdetav väärtus: tsentraalvenoosne rõhk (CVP), kopsuarteri kiilumisrõhk ja vasaku vatsakese lõppdiastoolne maht. Praktikas on neid parameetreid kasutatud infusioonravi vajalikkuse üle otsustamisel |
| Inotroopne ravim | Südamelihase kontraktiilsust parandav ravim (nt dobutamiin, levosimendaan ja milrinoon) |
| Isotooniline kristalloidlahus | Naatriumit ja teisi mineraalsooli ning vesilahustuvaid molekule sisaldav infusioonilahus, mis on vereplasma suhtes isoosmolaarne |
| Kapillaartäituvus | Naha perifeersete veresoonte täituvuse aeg pärast 10 sekundit kestnud mõõduka rõhuga survet sõrmepadjale. Hinnatakse visuaalselt naha värvuse järgi, normis on alla 3 sekundi |
| Koehüpoksia | Kudede hapnikuvaegus, mille tagajärjel käivitub anaeroobne metabolism |
| Kombineeritud antimikroobne ravi |
Eri antibiootikumirühmadesse kuuluvate ravimite kombineerimine (nt laiatoimeline beetalaktaamantibiootikum ja aminoglükosiid või fluorokinoloon), mille eesmärk on ühe haigustekitaja kiirem kõrvaldamine |
| Laiendatud toimespektriga antimikroobne ravi | Mitme antimikroobse ravimi samaaegne kasutamine, et see toimiks eri mikroorganismidele (nt kopsupõletiku korral beetalaktaamantibiootikum, makroliid ja viirusevastane ravim) |
| Multiresistentsus | Resistentsus vähemalt kolme antibiootikumirühma suhtes |
Sissejuhatus
Ravijuhendi koostamise vajadus ja eesmärk
Infektsioonhaigused kuuluvad maailmas kümne peamise surmapõhjuse hulka (2). Sepsis ja septiline šokk on infektsioonhaiguste raskeimaid esinemisvormid, mis vajavad kiiret tegutsemist ning nõuavad tervishoiusüsteemilt märkimisväärset inim- ja materiaalset ressurssi. Sepsise ja septilise šoki suremus ulatub kuni 40%-ni (3).
2014. aastal tehti Eestis kliiniline audit, milles hinnati sepsisehaigete käsitlust 12 aktiivravihaiglas. Audit näitas ilmekalt, et sepsis on valdavalt eakatel patsientidel esinev sündroom, millesse suremus on suur. Sepsise sagedasemad põhjused olid hingamisteede, urotrakti ja seedetrakti infektsioonid. 52% haigetest olid üle 70-aastased. Valimi haiglasuremus oli 42,4% ja kuue kuu suremus 59,2%. Vere- jm külvide tegemine oli sageli puudulik ja hiline, antibakteriaalset ravi alustati hilja ning infusioonravimi kogus oli ebapiisav (4).
Sepsis on kompleksne sündroom, mille ravimisel teevad koostööd mitme eriala spetsialistid ja kasutatakse paljusid tervishoiuteenuseid. Seetõttu on sepsise ravikulude andmeid Tervisekassa raviarvete andmebaasist keeruline leida.
Ravijuhendi eesmärk on ravistandardite loomise abil vähendada Eestis sepsise ja septilise šokiga patsientide ravi varieeruvust eri haiglates ning parandada sepsise esmast diagnostikat ja ravi. Ravijuhendi kasutamisel väheneb pikemas perspektiivis sepsise ja septilise šokiga patsientide suremus (5).
2014. aastal tehti Eestis kliiniline audit, milles hinnati sepsisehaigete käsitlust 12 aktiivravihaiglas. Audit näitas ilmekalt, et sepsis on valdavalt eakatel patsientidel esinev sündroom, millesse suremus on suur. Sepsise sagedasemad põhjused olid hingamisteede, urotrakti ja seedetrakti infektsioonid. 52% haigetest olid üle 70-aastased. Valimi haiglasuremus oli 42,4% ja kuue kuu suremus 59,2%. Vere- jm külvide tegemine oli sageli puudulik ja hiline, antibakteriaalset ravi alustati hilja ning infusioonravimi kogus oli ebapiisav (4).
Sepsis on kompleksne sündroom, mille ravimisel teevad koostööd mitme eriala spetsialistid ja kasutatakse paljusid tervishoiuteenuseid. Seetõttu on sepsise ravikulude andmeid Tervisekassa raviarvete andmebaasist keeruline leida.
Ravijuhendi eesmärk on ravistandardite loomise abil vähendada Eestis sepsise ja septilise šokiga patsientide ravi varieeruvust eri haiglates ning parandada sepsise esmast diagnostikat ja ravi. Ravijuhendi kasutamisel väheneb pikemas perspektiivis sepsise ja septilise šokiga patsientide suremus (5).
Ravijuhendi ajakohastamise vajadus
Ravijuhendi „Sepsise ja septilise šoki ravijuhend – esmane diagnostika ja ravivõtted“ ajakohastamine algatati, sest algse juhendi ilmumisest 2018. aastal oli möödunud viis aastat ning Eesti ravijuhendi koostamise aluseks olnud juhendit
„Surviving Sepsis Campaign International Guidelines for Management of Sepsis and Septic Shock“ (3, 6, 7) on samuti vahepeal ajakohastatud. Lisaks on avaldatud uusi teemakohaseid teadusuuringuid, mille toel on võimalik ajakohastada ka siinse juhendi soovitusi.
Ravijuhendis on muudetud soovitust tasakaalustatud isotooniliste soolalahuste kasutamise kohta ning täiendatud septilise šoki ravieesmärkide (sealjuures kapillaartäituvuse) ja vasopressoorse ravi soovitusi. Uute teemadena on ravijuhendisse lisatud soovitused sepsise või septilise šokiga patsiendi infektsioonikolde kirurgilise ravi ja patsiendi üldseisundi häire skriinimise kohta.
„Surviving Sepsis Campaign International Guidelines for Management of Sepsis and Septic Shock“ (3, 6, 7) on samuti vahepeal ajakohastatud. Lisaks on avaldatud uusi teemakohaseid teadusuuringuid, mille toel on võimalik ajakohastada ka siinse juhendi soovitusi.
Ravijuhendis on muudetud soovitust tasakaalustatud isotooniliste soolalahuste kasutamise kohta ning täiendatud septilise šoki ravieesmärkide (sealjuures kapillaartäituvuse) ja vasopressoorse ravi soovitusi. Uute teemadena on ravijuhendisse lisatud soovitused sepsise või septilise šokiga patsiendi infektsioonikolde kirurgilise ravi ja patsiendi üldseisundi häire skriinimise kohta.
Ravijuhendi käsitlusala ja sihtrühm
Ravijuhendis käsitletakse kõiki infektsioonhaigustega täiskasvanuid, nende diagnostikat ja ravi esimese 24 tunni jooksul. Ravijuhendist saab vastused küsimustele, kuidas sepsist ja septilist šokki ära tunda ning millist esmast diagnostikat ja ravi rakendada.
Ravijuhend on mõeldud kasutamiseks kõigile tervishoiutöötajatele (sealhulgas kiirabi, erakorralise meditsiini, sisehaiguste ja kirurgia, anestesioloogia ning intensiivravi vallas töötajatele), kes tegelevad infektsioonhaigusega patsientidega.
Ravijuhendis ei käsitleta (< 18-aastaste) laste sepsise ja septilise šoki ravi põhimõtteid. Juhendis ei keskenduta sepsise patogeneesile, konkreetsete infektsioonhaiguste diagnoosimisele ega antimikroobse ravi preparaatidele. Antimikroobse ravi valikul tuleb lähtuda kohalikest juhenditest. Samuti ei käsitleta sepsise ja septilise šoki intensiivravi spetsiifilisi küsimusi, näiteks kopsude kunstlik ventilatsioon, kliiniline toitmine, immuunmoduleeriv ravi jmt.
Ravijuhendi soovitustes lähtutakse tõenduspõhisusest ja kliinilisest praktikast. Ravijuhend ei asenda tervishoiutöötaja individuaalset vastutust teha õigeid raviotsuseid konkreetsest patsiendist lähtudes. Kõik ravijuhendi soovitused ei pruugi kõikidele patsientidele sobida.
Ravijuhend on mõeldud kasutamiseks kõigile tervishoiutöötajatele (sealhulgas kiirabi, erakorralise meditsiini, sisehaiguste ja kirurgia, anestesioloogia ning intensiivravi vallas töötajatele), kes tegelevad infektsioonhaigusega patsientidega.
Ravijuhendis ei käsitleta (< 18-aastaste) laste sepsise ja septilise šoki ravi põhimõtteid. Juhendis ei keskenduta sepsise patogeneesile, konkreetsete infektsioonhaiguste diagnoosimisele ega antimikroobse ravi preparaatidele. Antimikroobse ravi valikul tuleb lähtuda kohalikest juhenditest. Samuti ei käsitleta sepsise ja septilise šoki intensiivravi spetsiifilisi küsimusi, näiteks kopsude kunstlik ventilatsioon, kliiniline toitmine, immuunmoduleeriv ravi jmt.
Ravijuhendi soovitustes lähtutakse tõenduspõhisusest ja kliinilisest praktikast. Ravijuhend ei asenda tervishoiutöötaja individuaalset vastutust teha õigeid raviotsuseid konkreetsest patsiendist lähtudes. Kõik ravijuhendi soovitused ei pruugi kõikidele patsientidele sobida.
Ravijuhendi koostamine
Siinne ravijuhend on 2018. aastal valminud „Sepsise ja septilise šoki ravijuhend – esmane diagnostika ja ravivõtted“ ajakohastatud versioon.
Ravijuhendi ajakohastamiseks moodustati eri kutsealade esindajatest koosnev üheksaliikmeline töörühm (koosseis on esitatud ravijuhendi alguses), kellest osa liikmeid kuulus ka algse juhendi töörühma. Metoodilist nõu andis Tartu Ülikooli ravijuhendite püsisekretariaadi metoodikanõunik.
Ravijuhendite Nõukoda kinnitas ravijuhendi töörühma lõpliku koosseisu 5. juunil 2023 (vt ravijuhendi koostajad) ja ravijuhendi käsitlusala 29. augustil 2023. Ravi- juhendi käsitlusala sisaldas viit PICO-formaadis kliinilist küsimust ja kaht tervishoiu- korralduslikku küsimust (vt ravijuhendi käsitlusala veebilehel www.ravijuhend.ee).
Ravijuhendi koostamisel lähtuti Eesti ravijuhendite koostamise käsiraamatu (1) põhimõtetest. Kliiniliste küsimuste arutamiseks ja soovituste sõnastamiseks, tervishoiukorralduslikele küsimustele vastamiseks ning juhendi muude materjalide arutamiseks (patsiendijuhend, lisad jm) pidas töörühm kokku seitse koosolekut. Lisaks toimusid arutelud töörühma liikmetega koosolekutevahelisel ajal elektroonselt. Nii ravijuhendi käsitlusala koostamise eel kui ka edaspidi vaadati iga koosoleku alguses läbi töörühma ja sekretariaadi liikmete võimalike huvide konfliktide deklaratsioonid ning veenduti otsustajate kallutamatuses (vt ravijuhendi koostajate huvide deklaratsioonide koondit ja koosolekute protokolle veebilehelt www.ravijuhend.ee). Koosolek oli otsustusvõimeline, kui osales vähemalt ¾ töörühma liikmetest. Vastuvõetud otsused olid üksmeelsed.
Kui juhendi ajakohastamisel läbi töötatud teaduslik jm tõendusmaterjal ei andnud põhjust muuta algses ravijuhendis antud soovitust, ajakohastati vaid soovituse sõnastust.
Kui ajakohastatud ravijuhendis muudeti uue teadusliku tõendusmaterjali põhjal või muudel kaalutlustel soovituse sisu, tehti soovituse juurde märge
„[AJAKOHASTATUD 2024]“. Kui koostati täiesti uus soovitus, lisati soovitusele märge „[UUS 2024]“.
Ravijuhendi käsitlusala, täistekst, tõendusmaterjali kokkuvõtte tabelid, soovituste koostamise tabelid, rakenduskava, ravijuhendi koostajate huvide deklaratsioonide kokkuvõte ja töörühma koosolekute protokollid on kättesaadavad veebiaadressil www.ravijuhend.ee.
Pärast ravijuhendi kinnitamist ajakohastatakse seda uue olulise info lisandumisel või viie aasta pärast.
Ravijuhendi ajakohastamiseks moodustati eri kutsealade esindajatest koosnev üheksaliikmeline töörühm (koosseis on esitatud ravijuhendi alguses), kellest osa liikmeid kuulus ka algse juhendi töörühma. Metoodilist nõu andis Tartu Ülikooli ravijuhendite püsisekretariaadi metoodikanõunik.
Ravijuhendite Nõukoda kinnitas ravijuhendi töörühma lõpliku koosseisu 5. juunil 2023 (vt ravijuhendi koostajad) ja ravijuhendi käsitlusala 29. augustil 2023. Ravi- juhendi käsitlusala sisaldas viit PICO-formaadis kliinilist küsimust ja kaht tervishoiu- korralduslikku küsimust (vt ravijuhendi käsitlusala veebilehel www.ravijuhend.ee).
Ravijuhendi koostamisel lähtuti Eesti ravijuhendite koostamise käsiraamatu (1) põhimõtetest. Kliiniliste küsimuste arutamiseks ja soovituste sõnastamiseks, tervishoiukorralduslikele küsimustele vastamiseks ning juhendi muude materjalide arutamiseks (patsiendijuhend, lisad jm) pidas töörühm kokku seitse koosolekut. Lisaks toimusid arutelud töörühma liikmetega koosolekutevahelisel ajal elektroonselt. Nii ravijuhendi käsitlusala koostamise eel kui ka edaspidi vaadati iga koosoleku alguses läbi töörühma ja sekretariaadi liikmete võimalike huvide konfliktide deklaratsioonid ning veenduti otsustajate kallutamatuses (vt ravijuhendi koostajate huvide deklaratsioonide koondit ja koosolekute protokolle veebilehelt www.ravijuhend.ee). Koosolek oli otsustusvõimeline, kui osales vähemalt ¾ töörühma liikmetest. Vastuvõetud otsused olid üksmeelsed.
Kui juhendi ajakohastamisel läbi töötatud teaduslik jm tõendusmaterjal ei andnud põhjust muuta algses ravijuhendis antud soovitust, ajakohastati vaid soovituse sõnastust.
Kui ajakohastatud ravijuhendis muudeti uue teadusliku tõendusmaterjali põhjal või muudel kaalutlustel soovituse sisu, tehti soovituse juurde märge
„[AJAKOHASTATUD 2024]“. Kui koostati täiesti uus soovitus, lisati soovitusele märge „[UUS 2024]“.
Ravijuhendi käsitlusala, täistekst, tõendusmaterjali kokkuvõtte tabelid, soovituste koostamise tabelid, rakenduskava, ravijuhendi koostajate huvide deklaratsioonide kokkuvõte ja töörühma koosolekute protokollid on kättesaadavad veebiaadressil www.ravijuhend.ee.
Pärast ravijuhendi kinnitamist ajakohastatakse seda uue olulise info lisandumisel või viie aasta pärast.
Tõendusmaterjali otsimine ja hindamine
Ravijuhendi koostamiseks otsiti tõendusmaterjali Eesti ravijuhendite koostamise käsiraamatu (1) juhiste järgi. Esmalt otsiti kliiniliste küsimustega haakuvaid sepsist ja septilist šokki käsitlevaid tõenduspõhiseid ravijuhendeid. Leitud ravijuhendi
„Surviving Sepsis Campaign International Guidelines for Management of Sepsis and Septic Shock 2021“ (6) kvaliteeti hindas teineteisest sõltumatult kaks sekretariaadi liiget struktureeritud instrumendiga AGREE II. Hinnangutes märkimisväärseid lahknevusi ei esinenud.
Tõendusmaterjali kokkuvõtte koostamiseks tehti ka süstemaatilised otsingud andmebaasis PubMed (vt otsinguprotokollid). Läbi töötati süstemaatilisi ülevaateid, metaanalüüse ja üksikuuringuid, seejuures eelistati juhuslikustatud kontrolluuringuid (RCT), kuid tõendusmaterjali vähesuse tõttu arvestati ka jälgimisuuringuid. Ravijuhendi koostamisel kasutatud teadusartiklid on juhendi tekstis viidatud.
Iga kliinilise küsimuse kohta koostas sekretariaat tõendusmaterjali kokkuvõtte tabeli ja valmistas ette soovituse koostamise tabeli, kasutades veebipõhist tööriista GRADEpro. Koos ravijuhendi töörühmaga arutati soovituse koostamiseks lisaks teaduslikule tõendusmaterjalile (sh huvipakkuva meetodi või tegevuse kasu-kahju tasakaal) läbi patsientide eelistused ja väärtushinnangud, meetodi või tegevuse vastuvõetavus, teostatavus ja ressursivajadus. Soovituse koostamise tabelile tuginedes sõnastas töörühm üksmeelselt soovituse. Iga soovituse põhjendus on kokkuvõtlikult kirjas juhendi tekstis soovituse järel. Mitmel juhul suurendati soovituse tugevust, pidades silmas GRADE-metoodika juhiseid.
„Surviving Sepsis Campaign International Guidelines for Management of Sepsis and Septic Shock 2021“ (6) kvaliteeti hindas teineteisest sõltumatult kaks sekretariaadi liiget struktureeritud instrumendiga AGREE II. Hinnangutes märkimisväärseid lahknevusi ei esinenud.
Tõendusmaterjali kokkuvõtte koostamiseks tehti ka süstemaatilised otsingud andmebaasis PubMed (vt otsinguprotokollid). Läbi töötati süstemaatilisi ülevaateid, metaanalüüse ja üksikuuringuid, seejuures eelistati juhuslikustatud kontrolluuringuid (RCT), kuid tõendusmaterjali vähesuse tõttu arvestati ka jälgimisuuringuid. Ravijuhendi koostamisel kasutatud teadusartiklid on juhendi tekstis viidatud.
Iga kliinilise küsimuse kohta koostas sekretariaat tõendusmaterjali kokkuvõtte tabeli ja valmistas ette soovituse koostamise tabeli, kasutades veebipõhist tööriista GRADEpro. Koos ravijuhendi töörühmaga arutati soovituse koostamiseks lisaks teaduslikule tõendusmaterjalile (sh huvipakkuva meetodi või tegevuse kasu-kahju tasakaal) läbi patsientide eelistused ja väärtushinnangud, meetodi või tegevuse vastuvõetavus, teostatavus ja ressursivajadus. Soovituse koostamise tabelile tuginedes sõnastas töörühm üksmeelselt soovituse. Iga soovituse põhjendus on kokkuvõtlikult kirjas juhendi tekstis soovituse järel. Mitmel juhul suurendati soovituse tugevust, pidades silmas GRADE-metoodika juhiseid.
Ravijuhendi soovitused
Sepsise äratundmine |
||
| 1 |
|
Sepsise äratundmiseks kasutage SIRS-i kriteeriume ja hinnake elundipuudulikkuse olemasolu. Tugev positiivne soovitus, väga madal tõendatuse aste |
Patsiendi üldseisundi häire äratundmine |
||
| 2 |
|
Haiglaravil oleva patsiendi üldseisundi häire äratundmiseks ja ravi planeerimiseks kasutage raviasutuses ühtset skoori, näiteks NEWS-2. [UUS 2024] Praktiline soovitus |
Esmane diagnostika ja ravi |
||
| Vedelikravi | ||
| 3 |
|
Kohe pärast sepsise äratundmist alustage vedelikravi isotoonilise kristalloidlahuse 500 ml boolusega ning jätkake sellega, kuni saavutate oodatud kliinilise efekti. Praktiline soovitus |
| 4 |
|
Sepsise, sh septilise šoki esmases vedelikravis eelistage tasakaalustatud isotoonilist kristalloidlahust. [AJAKOHASTATUD 2024] Nõrk positiivne soovitus, madal tõendatuse aste |
| 5 |
|
Sepsise, sh septilise šoki esmaseks vedelikraviks pigem ärge kasutage želatiinipreparaate. Nõrk negatiivne soovitus, madal tõendatuse aste |
| Antimikroobne ravi | ||
| 6 |
|
Sepsise, sh septilise šoki äratundmisel alustage empiirilist antimikroobset ravi ühe tunni jooksul. Tugev positiivne soovitus, madal tõendatuse aste |
| 7 |
|
Enne empiirilise antimikroobse ravi alustamist tehke verekülvid. Teised mikrobioloogiliseks uuringuks asjakohased proovid (hingamisteede sekreet, uriin, liikvor, pleuravedelik jm) võtke vaid juhul, kui ravi algus selle tõttu ei hiline. Praktiline soovitus |
| 8 |
|
Sepsise, sh septilise šokiga neutropeenilise patsiendi empiirilises ravis pigem ärge kasutage kahe antibiootikumi kombinatsiooni. Nõrk negatiivne soovitus, madal tõendatuse aste |
| 9 |
|
Sepsise, sh septilise šokiga neutropeenilise patsiendi empiirilises ravis kasutage kahe antibiootikumi kombinat- siooni juhul, kui patsiendil on varem esinenud koloniseeritust või infektsioone multiresistentsete gramnegatiivsete mikroorganismidega. Praktiline soovitus |
| 10 |
|
Sepsise, sh septilise šokiga neutropeenilisel patsiendil, kelle neutropeenia põhjuseks on pahaloomuline kasvaja, hematoloogiline haigus või nende ravi, peaks koos antibiootikumidega alustama ka empiirilist seenevastast ravi. Nõrk positiivne soovitus, madal tõendatuse aste |
Infektsioonikolde kontroll |
||
| 11 |
|
Sepsise, sh septilise šokiga patsiendil proovige saavutada kontroll infektsioonikolde üle võimalikult kiiresti kas kirurgilise saneerimise või perkutaanse dreenimisega. Tugev positiivne soovitus, madal tõendatuse aste |
| 12 |
|
Kirurgiliselt ravitava haiguse korral rakendage infektsiooni- kolde kontroll nii kiiresti kui võimalik:
|
| 13 |
|
Kui haiglas puuduvad infektsioonikolde diagnoosimise ja/ või lahendamise võimalused, saatke patsient kõrgema etapi haiglasse. [UUS 2024] Praktiline soovitus |
Koeperfusiooni hindamine |
||
| 14 |
|
Sepsisekahtlusega patsiendil hinnake kapillaartäituvust. [UUS 2024] Praktiline soovitus |
| 15 |
|
Sepsisekahtlusega patsiendil määrake plasma laktaadisisaldus ning tehke vähemalt üks kordusanalüüs järgneva kuue tunni jooksul. Praktiline soovitus |
| 16 |
|
Septilise šoki korral võtke ravieesmärgiks kapillaartäituvuse ja laktaadisisalduse normaliseerimine. [AJAKOHASTATUD 2024] Tugev positiivne soovitus, madal tõendatuse aste |
| 17 |
|
Sepsise, sh septilise šoki korral pigem ärge tehke hüpoper- fusioonist tingitud laktatsidoosi raviks naatriumbikarbonaadi infusiooni. Nõrk negatiivne soovitus, väga madal tõendatuse aste |
| 18 |
|
Naatriumbikarbonaadi kasutamist kaaluge juhul, kui arteriaalse vere pH on alla 7,15, eriti kui metaboolse atsidoosi põhjusena tulevad arvesse teised seisundid peale hüpoperfusiooni (krooniline neerupuudulikkus, mürgistused jmt). Praktiline soovitus |
Vasopressoorne ja inotroopne ravi |
||
| 19 |
|
Septilise šoki korral seadke vasopressoorse ravi eesmärgiks keskmine arteriaalne vererõhk (MAP) vähemalt 65 mm Hg. Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 20 |
|
Septilise šoki korral kasutage vasopressoorse ravi esma- valikuna noradrenaliini. Tugev positiivne soovitus, kõrge tõendatuse aste |
| 21 |
|
Septilise šoki korral pigem ärge kasutage rutiinselt inotroopset ravi. Nõrk negatiivne soovitus, madal tõendatuse aste |
| 22 |
|
Inotroopset ravi alustage olukordades, kus on tekkinud tõsine kahtlus või on juba tõestatud, et hüpoperfusiooni põhjus on südame vähene minutimaht ja südamelihase vähenenud kontraktiilsus. Praktiline soovitus |
| 23 |
|
Septilise šoki korral kaaluge noradrenaliinile vasopressiini lisamist, kui noradrenaliini kasutamisega ei ole saavutatud oodatud efekti vereringele. [AJAKOHASTATUD 2024] Nõrk positiivne soovitus, madal tõendatuse aste |
Kortikosteroidide kasutamine |
||
| 24 |
|
Septilise šoki ravis kaaluge väikeses annuses kortikosteroidide kasutamist. Nõrk positiivne soovitus, madal tõendatuse aste |
Eelkoormuse parameetrid |
||
| 25 |
|
Sepsise, sh septilise šoki korral kaaluge vedelikutundlikkuse hindamiseks eelkoormuse dünaamiliste parameetrite mõõtmist. Nõrk positiivne soovitus, väga madal tõendatuse aste |
Edasise ravi korraldus |
||
| 26 |
|
Sepsise, sh septilise šokiga patsiendi haiglaravikoha otsustamisel lähtuge tema kliinilisest seisundist ja konkreetse haigla ravikorraldusest. Praktiline soovitus |
| 27 |
|
Kaaluge intensiivravivajadust, kui patsiendi plasma laktaadisisalduse absoluutväärtus on üle 4 mmol/L või pole vähenema hakanud (20% võrra ühe tunni jooksul pärast ravi alustamist). Nõrk positiivne soovitus, madal tõendatuse aste |
| 28 |
|
Sepsise, sh septilise šokiga patsiendil, kes põeb rasket kroonilist haigust, kaaluge parima toetava ravi rakendamist. [AJAKOHASTATUD 2024] Nõrk positiivne soovitus, väga madal tõendatuse aste |
Ravijuhendi soovitused koos tõendusmaterjali lühikokkuvõttega
Sepsise äratundmine
| 1 |
|
Sepsise äratundmiseks kasutage SIRS-i kriteeriume ja hinnake elundipuudulikkuse olemasolu. Tugev positiivne soovitus, väga madal tõendatuse aste |
Sepsis on eluohtlik elundipuudulikkus, mida põhjustab organismi ebaadekvaatne reaktsioon infektsioonile.
Septiline šokk on adekvaatsest infusioonravist hoolimata püsiv arteriaalne hüpotensioon, mille tõttu on vajalik vasopressoorne ravi ja millega kaasneb laktaadisisalduse suurenemine plasmas üle 2 mmol/L (8).
Sepsis on sündroom, mille diagnoosimiseks puudub standard. Sarnaselt insuldile, müokardiinfarktile ja liittraumale on seisund ajakriitiline. Seega on sündroomi kiire äratundmine ja esimeste tundide ravivõtete adekvaatsus haige tervenemise jaoks määrava tähtsusega.
Sepsist põhjustavad peamised infektsioonhaigused on hingamisteede, kõhukoopa, urotrakti ning naha ja pehmete kudede infektsioonid.
Sepsise, sh septilise šoki kujunemise riskitegurid on järgmised:
Sepsist põhjustavad peamised infektsioonhaigused on hingamisteede, kõhukoopa, urotrakti ning naha ja pehmete kudede infektsioonid.
Sepsise, sh septilise šoki kujunemise riskitegurid on järgmised:
- kõrge vanus (> 75 a);
- immunosupressioon (sh diabeet, kemoteraapia, pikaaegne süsteemne korti- kosteroidravi);
- hiljutine, kuue nädala jooksul tehtud operatsioon või invasiivne protseduur;
- süstitavate narkootikumide tarvitamine;
- naha kaitsebarjääri kahjustumine (nt põletus, haav);
- püsikateetrid või -liinid (nt kusepõiekateeter, tsentraalveenikateeter, dialüüsi- kateeter). (9)
Sepsis ja sellega seotud terminid defineeriti rahvusvaheliselt esimest korda ACCP-i ja SCCM-i konsensuskonverentsil 1991. aastal (Sepsis-1) (10). Uus arusaam sepsise patobioloogiast tingis definitsioonide muutmise 2001. (Sepsis-2) (11) ja 2016. aastal
(Sepsis-3) (8).Sepsise definitsioonides on sündroomi äratundmiseks soovitatud kasutada süsteemse põletikureaktsiooni (SIRS) kriteeriume ja hinnata elundipuudulikkust (10, 11). Määratluste probleemiks peeti aga liigset SIRS-ile keskendumist. Leiti, et selle esinemine ei tähenda ilmtingimata organismi ülemäärast vastust infektsioonile. Seepärast on viimastes definitsioonides soovitatud haigla eel, erakorralise meditsiini ja tavaosakonnas halva prognoosiga patsientide tuvastamiseks kasutada qSOFA-skoori (≥ 2 punkti) ja elundipuudulikkuse hindamiseks SOFA-skoori dünaamikat (≥ 2 punkti) (8).
SIRS-i kriteeriumid:
- palavik või hüpotermia (> 38,3 °C või < 36 °C)
- tahhükardia (> 90 löögi minutis)
- tahhüpnoe (> 20 korra minutis või pCO2 < 32 mm Hg)
- leukotsütoos, leukopeenia (WBC > 12 × 109/L või < 4 × 109/L) või üle 10% leukotsüütide noori vorme (kepptuumseid neutrofiile)
qSOFA-skoor:
- hüpotensioon (süstoolne vererõhk ≤ 100 mm Hg)
- tahhüpnoe (hingamissagedus ≥ 22 korda minutis)
- teadvushäire (GKS < 15)
| Hingamissüsteem | |
| PaO2/FiO2 % (mm Hg / %) | |
| > 400 | 0 |
| < 400 | 1 |
| < 300 | 2 |
| < 200 ja KKV | 3 |
| < 100 ja KKV | 4 |
| Hüübimissüsteem | |
| Trombotsüüdid (× 109/L) | |
| > 150 | 0 |
| < 150 | 1 |
| < 100 | 2 |
| < 50 | 3 |
| < 20 | 4 |
| Maks | |
| Bilirubiin (mmol/L) | |
| < 20 | 0 |
| 20–32 | 1 |
| 33–101 | 2 |
| 102–204 | 3 |
| > 204 | 4 |
| Südame-veresoonkond | |
| Hüpotensioon / MAP | |
| Pole hüpotensiooni | 0 |
| MAP < 70 mm Hg | 1 |
| Dopamiin ≤ 5* või Dobutamiin (iga doos) |
2 |
| Dopamiin > 5* või Adrenaliin ≤ 0,1 või Noradrenaliin ≤ 0,1 | 3 |
| Dopamiin > 15 või Adrenaliin > 0,1 või Noradrenaliin > 0,1 | 4 |
| Kesknärvisüsteem | |
| GKS | |
| 15 | 0 |
| 13–14 | 1 |
| 10–12 | 2 |
| 6–9 | 3 |
| < 6 | 4 |
| Neerud | |
| Kreatiniin (µmol/L) või 24 tunni uriini hulk (mL) | |
| < 110 | 0 |
| 110–170 | 1 |
| 171–299 | 2 |
| 300–440 või < 500 mL 24 tunni kohta | 3 |
| > 440 või < 200 mL 24 tunni kohta | 4 |
| * Kui adrenergilisi aineid manustatakse vähemalt ühe tunni vältel (annused: mg/kg/min) | |
Soovitus SOFA- ja qSOFA-skoori kasutamiseks põhineb tervise andmebaaside põhjal tehtud retrospektiivsel kohortuuringul, mille eesmärk oli hinnata kliinilisi kriteeriume, mis aitaksid määrata infektsioonhaiguse kahtlusega patsientidel sepsise riski. Lisaks SIRS-i kriteeriumitele ning SOFA- ja LODS-i skoorile tuletati ja valideeriti uus mõõdiksüsteem – qSOFA-skoor. Tulemusnäitajad olid haiglasuremus ja viibimine intensiivraviosakonnas kolm või enam päeva. Autorite hinnangul oli väljaspool intensiivraviosakonda ravitud haigete jaoks qSOFA- skoor suremuse ennustamisel tugevama väärtusega kui SIRS-i kriteeriumid [ROC-kõvera alune pindala qSOFA 0,81 (95% CI 0,80–0,82) vs. SIRS 0,76 (95%
CI 0,75–0,77)] (12).
CI 0,75–0,77)] (12).
Eelnimetatud uuring ja qSOFA-skoor on tekitanud rahvusvaheliselt palju diskussiooni. Probleemiks peetakse seda, et analüüs on retrospektiivne. Uurijad ei tõestanud, et qSOFA on parim olemasolev skoor, ROC-kõvera aluse pindala erinevus ei pruugi olla kliiniliselt oluline. Lisaks on uuring tehtud peamiselt Ameerika Ühendriikides ja puuduvad prospektiivsed uuringud, mis tõestaksid qSOFA kliinilist kasu (13, 14). Samuti tuuakse esile, et hoolimata SIRS-i kriteeriumite madalast spetsiifilisusest on need kogu maailmas kliinilises praktikas juurdunud ning sepsise äratundmiseks soovitatakse kombineerida SIRS-i kriteeriume qSOFA-skooriga (15).
Ravijuhendis „Surviving Sepsis Campaign 2016“ ei käsitleta sepsise diagnoosimist, küll aga viidatakse Sepsis-3 kriteeriumitele. Rõhutatakse, et qSOFA ei diagnoosi sepsist, kuid patsientidel, kelle qSOFA-skoor on kaks või enam, on pikem intensiivravivajadus ja suurem risk surra (16).
NICE-i sepsise ravijuhendis on esitatud ja hinnatud eri skoorisüsteeme. Autorite arvates võib neist olla kasu suure riskiga patsientide tuvastamiseks, kuid puudub piisav tõendusmaterjal ühe või teise skoori eelistamiseks (uuringute tõendatuse aste on enamasti väga madal). Eksperdiarvamuse kohaselt soovitatakse otsida kõikidel infektsioonhaiguse kahtlusega patsientidel infektsioonikollet ning hinnata sepsise riskitegureid ja kõrvalekaldeid käitumises, vereringes ja hingamises (9).
Ravijuhendi koostamise ajal avaldati väga madala kvaliteediga süstemaatiline ülevaade ja metaanalüüs. Selles võrreldi qSOFA-skoori ja SIRS-i kriteeriumite võimet ennustada väljaspool intensiivraviosakonda ravil olevate infektsioonhaiguse kahtlusega patsientide haiglasuremust, elundipuudulikkuse teket (SOFA-skoori suurenemine > 2 punkti või SIRS ≥ 2 koos vähemalt ühe elundi puudulikkusega) ning intensiivraviosakonda hospitaliseerimist. Analüüsi kaasati 23 kohortuuringut (n=146 551).
Ravijuhendis „Surviving Sepsis Campaign 2016“ ei käsitleta sepsise diagnoosimist, küll aga viidatakse Sepsis-3 kriteeriumitele. Rõhutatakse, et qSOFA ei diagnoosi sepsist, kuid patsientidel, kelle qSOFA-skoor on kaks või enam, on pikem intensiivravivajadus ja suurem risk surra (16).
NICE-i sepsise ravijuhendis on esitatud ja hinnatud eri skoorisüsteeme. Autorite arvates võib neist olla kasu suure riskiga patsientide tuvastamiseks, kuid puudub piisav tõendusmaterjal ühe või teise skoori eelistamiseks (uuringute tõendatuse aste on enamasti väga madal). Eksperdiarvamuse kohaselt soovitatakse otsida kõikidel infektsioonhaiguse kahtlusega patsientidel infektsioonikollet ning hinnata sepsise riskitegureid ja kõrvalekaldeid käitumises, vereringes ja hingamises (9).
Ravijuhendi koostamise ajal avaldati väga madala kvaliteediga süstemaatiline ülevaade ja metaanalüüs. Selles võrreldi qSOFA-skoori ja SIRS-i kriteeriumite võimet ennustada väljaspool intensiivraviosakonda ravil olevate infektsioonhaiguse kahtlusega patsientide haiglasuremust, elundipuudulikkuse teket (SOFA-skoori suurenemine > 2 punkti või SIRS ≥ 2 koos vähemalt ühe elundi puudulikkusega) ning intensiivraviosakonda hospitaliseerimist. Analüüsi kaasati 23 kohortuuringut (n=146 551).
Tulemused olid heterogeensed. Leiti, et patsientidel, kelle qSOFA-skoor oli ≥ 2, oli haiglasuremus 12,9% (3847/29 709-st), äge elundipuudulikkus tekkis 82,8%-l (2433-l 2936-st) ning intensiivraviosakonda hospitaliseeriti 37% (5323/14 384-st). SIRS-i kriteeriumite korral olid vastavad näitajad 5,8% (3906/67 225-st), 36,2% (1830/5047-st) ning 24,3% (6741/27 759-st). Haiglasuremuse ennustamisel oli qSOFA tundlikkus 0,51 (95% CI 0,39–0,62), spetsiifilisus 0,83 (95% CI 0,74–0,89); SIRS-i kriteeriumite tundlikkus 0,86 (95% CI 0,79–0,92), spetsiifilisus 0,29
(95% CI 0,17–0,45). Elundipuudulikkuse korral oli qSOFA tundlikkus 0,47 (95%
CI 0,28–0,66), spetsiifilisus 0,93 (95% CI 0,88–0,97); SIRS-i kriteeriumite
tundlikkus 0,83 (95% CI 0,71–0,91), spetsiifilisus 0,49 (95% CI 0,29–0,69). Intensiivraviosakonda hospitaliseerimise korral oli qSOFA tundlikkus 0,53 (95% CI 0,52–0,54), spetsiifilisus 0,75 (95% CI 0,75–0,76); SIRS-i kriteeriumite tundlikkus 0,91 (95% CI 0,90–0,92), spetsiifilisus 0,14 (95% CI 0,13–0,14). Autorid järeldasid, et qSOFA on küll halva prognoosi ennustamisel spetsiifiline skoor, kuid selle kasutamist piirab madal tundlikkus (17).
qSOFA-skoori haiglaeelset kasutatavust on uuritud ühes väga madala kvaliteediga retrospektiivses kohortuuringus, kus vaadeldi 152 sepsise ja septilise šokiga patsienti. Leiti, et haigla eel on qSOFA tundlikkus sepsise ja septilise šoki äratundmiseks väga madal: tundlikkus oli 16,3% (95% CI 6,8–30,7%) ja spetsiifilisus 97,3% (95% CI 92,1–99,4%) (18).
Ravijuhendi töörühm arutas, et sepsise äratundmiseks on kriteeriumi või skoori tundlikkus olulisem kui spetsiifilisus. Olemasoleva tõendusmaterjali alusel on SIRS-i kriteeriumid tundlikumad kui qSOFA-skoor. qSOFA-skoor ≥ 2 võimaldab tuvastada mistahes haiguse tõttu raskes üldseisundis olevad patsiendid, kellel on suure tõenäosusega halvem prognoos. qSOFA hõlmab ainult kolme elundisüsteemi ja seda ei saa kasutada kõikidel patsientidel (nt teadvushäire hindamist kognitiivse funktsiooni häirega patsientidel või süstoolse arteriaalse vererõhu piiri 100 mm Hg kasutamist kõrgvererõhktõvega patsientidel). SIRS sisaldab rohkem viiteid infektsioonile.
Otsustati, et sepsise definitsioonis tuleb jääda Sepsis-3 sõnastuse juurde ja sepsise äratundmiseks tuleb kasutada SIRS-i kriteeriume ning kliiniliselt hinnata elundipuudulikkust. Tähtsaimad ja kiireimini hinnatavad elundipuudulikkusele viitavad sümptomid on teadvushäire, hingamissagedus üle 22 korra minutis ja arteriaalne hüpotensioon. Tähelepanu tuleb pöörata neeru- ja maksapuudulikkuse sümptomitele (oliguuria, laktaadi, kreatiniini ja bilirubiinisisalduse suurenemine). Samu sepsise kriteeriumeid on võimalik mõningate piirangutega (nt laborianalüüside tulemusteta) kasutada ka haigla eel.
(95% CI 0,17–0,45). Elundipuudulikkuse korral oli qSOFA tundlikkus 0,47 (95%
CI 0,28–0,66), spetsiifilisus 0,93 (95% CI 0,88–0,97); SIRS-i kriteeriumite
tundlikkus 0,83 (95% CI 0,71–0,91), spetsiifilisus 0,49 (95% CI 0,29–0,69). Intensiivraviosakonda hospitaliseerimise korral oli qSOFA tundlikkus 0,53 (95% CI 0,52–0,54), spetsiifilisus 0,75 (95% CI 0,75–0,76); SIRS-i kriteeriumite tundlikkus 0,91 (95% CI 0,90–0,92), spetsiifilisus 0,14 (95% CI 0,13–0,14). Autorid järeldasid, et qSOFA on küll halva prognoosi ennustamisel spetsiifiline skoor, kuid selle kasutamist piirab madal tundlikkus (17).
qSOFA-skoori haiglaeelset kasutatavust on uuritud ühes väga madala kvaliteediga retrospektiivses kohortuuringus, kus vaadeldi 152 sepsise ja septilise šokiga patsienti. Leiti, et haigla eel on qSOFA tundlikkus sepsise ja septilise šoki äratundmiseks väga madal: tundlikkus oli 16,3% (95% CI 6,8–30,7%) ja spetsiifilisus 97,3% (95% CI 92,1–99,4%) (18).
Ravijuhendi töörühm arutas, et sepsise äratundmiseks on kriteeriumi või skoori tundlikkus olulisem kui spetsiifilisus. Olemasoleva tõendusmaterjali alusel on SIRS-i kriteeriumid tundlikumad kui qSOFA-skoor. qSOFA-skoor ≥ 2 võimaldab tuvastada mistahes haiguse tõttu raskes üldseisundis olevad patsiendid, kellel on suure tõenäosusega halvem prognoos. qSOFA hõlmab ainult kolme elundisüsteemi ja seda ei saa kasutada kõikidel patsientidel (nt teadvushäire hindamist kognitiivse funktsiooni häirega patsientidel või süstoolse arteriaalse vererõhu piiri 100 mm Hg kasutamist kõrgvererõhktõvega patsientidel). SIRS sisaldab rohkem viiteid infektsioonile.
Otsustati, et sepsise definitsioonis tuleb jääda Sepsis-3 sõnastuse juurde ja sepsise äratundmiseks tuleb kasutada SIRS-i kriteeriume ning kliiniliselt hinnata elundipuudulikkust. Tähtsaimad ja kiireimini hinnatavad elundipuudulikkusele viitavad sümptomid on teadvushäire, hingamissagedus üle 22 korra minutis ja arteriaalne hüpotensioon. Tähelepanu tuleb pöörata neeru- ja maksapuudulikkuse sümptomitele (oliguuria, laktaadi, kreatiniini ja bilirubiinisisalduse suurenemine). Samu sepsise kriteeriumeid on võimalik mõningate piirangutega (nt laborianalüüside tulemusteta) kasutada ka haigla eel.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 1 tõendusmaterjali kokkuvõtteid.
Patsiendi üldseisundi häire äratundmine
| 2 |
|
Haiglaravil oleva patsiendi üldseisundi häire äratundmiseks ja ravi planeerimiseks kasutage raviasutuses ühtset skoori, näiteks NEWS-2. [UUS 2024] Praktiline soovitus |
Esmane diagnostika ja ravi
Vedelikravi
| 3 |
|
Kohe pärast sepsise äratundmist alustage vedelikravi isotoonilise kristalloidlahuse 500 ml boolusega ning jätkake sellega, kuni saavutate oodatud kliinilise efekti. Praktiline soovitus |
Vedelikravi on sepsise ja septilise šoki ravi üks nurgakividest. Praktilisest vaatenurgast on oluline, kas soovitada infusioonibooluseid või kehakaalule kohandatud infusiooni, eriti haiglaeelsel ajal ja erakorralise meditsiini osakonnas (EMO).
Rahvusvaheliste juhendite soovitused erinevad. Ravijuhendis „Surviving Sepsis Campaign 2016“ soovitatakse esmaseks vedelikraviks kasutada kristalloidlahust 30 ml/kg kolme tunni jooksul, kuid jääb ebaselgeks, millel see soovitus põhineb (3).
Üks võimalik põhjus võib olla aastatel 2014–2015 publitseeritud juhuslikustatud kontrolluuringud, kus võrreldi sepsise ja septilise šoki varajast eesmärgistatud ravi (early goal directed therapy, EGDT (20)) standardraviga (ProCESS 2014 (21), ARISE 2014 (22), ProMISE 2015 (23)), samuti 2017. aastal avaldatud metaanalüüs (PRISM 2017 (24)), mis hõlmas 3723 patsienti. Patsiendid viibisid enne juhuslikkuse alusel uuringurühmadesse jagamist 147–170 minutit EMO-s ning said selle aja jooksul 1912–2500 ml lahust. Kehakaalule kohandatult oli see 22,7–33,0 ml/kg. 90 päeva suremuse, neeruasendusravi vajaduse ega vasopressorite kasutuses rühmade vahel statistiliselt olulist erinevust ei esinenud (24).
Ravijuhendi „Surviving Sepsis Campaign 2016“ autorite põhjendus oli ka see, et 30 ml/kg kristalloidlahust kolme esimese tunni jooksul annab raviarstile väärtuslikku lisaaega, et tegeleda sepsise või septilise šoki täpsema diagnostika ja muude probleemide lahendamisega (3).
NICE-i 2013. ja 2017. aasta vedelikravi juhendis antakse soovitus manustada kristalloidlahust 500 ml kuni 15 minuti jooksul ning jätkata 500 ml boolustena vajaduse põhjal (25, 26).
Lisatõendusmaterjali päringuga leiti viis madala astme tõendatusega jälgimisuuringut. Neis näidati, et vedelikravi protokollipõhine kasutamine vähendab intensiivravihaigete suremust (27), suuremas koguses infusioonilahuse manustamine sepsisehaigetele esimese kolme tunni jooksul suurendab ellujäämisvõimalust (28) ning infusioonraviga alustamine esimese 30 minuti jooksul võib suurendada ellujäämisvõimalust (29). Neerukahjustust esines vähem, kui patsiendid said rohkem infusioonravi, samas suurenes aga kardiovaskulaarsete kõrvaltoimete risk (30). Standardravi ega protokollipõhine ravi ei vähendanud vasopressorite kasutamise kestust (31).
Ravijuhendi töörühma arvates jääb ravijuhendis „Surviving Sepsis Campaign 2016“ antud soovitus manustada esimese kolme tunni jooksul 30 ml/kg kristalloidlahust ebaselgeks ja juhendi tõendusmaterjal on vastuoluline. Selle soovituse rakendamine võib teatud haigetel tähendada liigset vedelikukoormust ja soovimatut efekti (nt kopsuturse teke kaasuva kroonilise südamepuudlikkuse või kopsupõletiku korral). Kõhukoopa infektsioonist tingitud sepsisega haiged on aga tavaliselt rohkem dehüdreerunud ning vajavad seega enam infusioonravi suures koguses.
Kiirabis ja erakorralise meditsiini osakondades ei ole üldjuhul infusioonipumpasid. Seetõttu ei ole ka kehakaalule kohandatud infusioonravi adekvaatselt teostatav.
Arvestades eelnevat ja seda, et boolusena manustamine on kliinilises praktikas juurdunud, otsustas töörühm soovitada 500 ml infusiooniboolusena manustamist. See tähendab, et vedelik tuleb patsiendile üle kanda kuni 30 minuti jooksul. Tähtis on silmas pidada, et ka liigsel infusioonil on negatiivsed tagajärjed: kopsupais ja
-turse, neerupuudulikkuse süvenemine jm. Seetõttu on vaja ära tunda kopsupaisule vihjavad kliinilised sümptomid, mille tekkel tuleb infusioonravi piirata.
Rahvusvaheliste juhendite soovitused erinevad. Ravijuhendis „Surviving Sepsis Campaign 2016“ soovitatakse esmaseks vedelikraviks kasutada kristalloidlahust 30 ml/kg kolme tunni jooksul, kuid jääb ebaselgeks, millel see soovitus põhineb (3).
Üks võimalik põhjus võib olla aastatel 2014–2015 publitseeritud juhuslikustatud kontrolluuringud, kus võrreldi sepsise ja septilise šoki varajast eesmärgistatud ravi (early goal directed therapy, EGDT (20)) standardraviga (ProCESS 2014 (21), ARISE 2014 (22), ProMISE 2015 (23)), samuti 2017. aastal avaldatud metaanalüüs (PRISM 2017 (24)), mis hõlmas 3723 patsienti. Patsiendid viibisid enne juhuslikkuse alusel uuringurühmadesse jagamist 147–170 minutit EMO-s ning said selle aja jooksul 1912–2500 ml lahust. Kehakaalule kohandatult oli see 22,7–33,0 ml/kg. 90 päeva suremuse, neeruasendusravi vajaduse ega vasopressorite kasutuses rühmade vahel statistiliselt olulist erinevust ei esinenud (24).
Ravijuhendi „Surviving Sepsis Campaign 2016“ autorite põhjendus oli ka see, et 30 ml/kg kristalloidlahust kolme esimese tunni jooksul annab raviarstile väärtuslikku lisaaega, et tegeleda sepsise või septilise šoki täpsema diagnostika ja muude probleemide lahendamisega (3).
NICE-i 2013. ja 2017. aasta vedelikravi juhendis antakse soovitus manustada kristalloidlahust 500 ml kuni 15 minuti jooksul ning jätkata 500 ml boolustena vajaduse põhjal (25, 26).
Lisatõendusmaterjali päringuga leiti viis madala astme tõendatusega jälgimisuuringut. Neis näidati, et vedelikravi protokollipõhine kasutamine vähendab intensiivravihaigete suremust (27), suuremas koguses infusioonilahuse manustamine sepsisehaigetele esimese kolme tunni jooksul suurendab ellujäämisvõimalust (28) ning infusioonraviga alustamine esimese 30 minuti jooksul võib suurendada ellujäämisvõimalust (29). Neerukahjustust esines vähem, kui patsiendid said rohkem infusioonravi, samas suurenes aga kardiovaskulaarsete kõrvaltoimete risk (30). Standardravi ega protokollipõhine ravi ei vähendanud vasopressorite kasutamise kestust (31).
Ravijuhendi töörühma arvates jääb ravijuhendis „Surviving Sepsis Campaign 2016“ antud soovitus manustada esimese kolme tunni jooksul 30 ml/kg kristalloidlahust ebaselgeks ja juhendi tõendusmaterjal on vastuoluline. Selle soovituse rakendamine võib teatud haigetel tähendada liigset vedelikukoormust ja soovimatut efekti (nt kopsuturse teke kaasuva kroonilise südamepuudlikkuse või kopsupõletiku korral). Kõhukoopa infektsioonist tingitud sepsisega haiged on aga tavaliselt rohkem dehüdreerunud ning vajavad seega enam infusioonravi suures koguses.
Kiirabis ja erakorralise meditsiini osakondades ei ole üldjuhul infusioonipumpasid. Seetõttu ei ole ka kehakaalule kohandatud infusioonravi adekvaatselt teostatav.
Arvestades eelnevat ja seda, et boolusena manustamine on kliinilises praktikas juurdunud, otsustas töörühm soovitada 500 ml infusiooniboolusena manustamist. See tähendab, et vedelik tuleb patsiendile üle kanda kuni 30 minuti jooksul. Tähtis on silmas pidada, et ka liigsel infusioonil on negatiivsed tagajärjed: kopsupais ja
-turse, neerupuudulikkuse süvenemine jm. Seetõttu on vaja ära tunda kopsupaisule vihjavad kliinilised sümptomid, mille tekkel tuleb infusioonravi piirata.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 5 tõendusmaterjali kokkuvõtteid.
| 4 |
|
Sepsise, sh septilise šoki esmases vedelikravis eelistage tasakaalustatud isotoonilist kristalloidlahust. [AJAKOHASTATUD 2024] Nõrk positiivne soovitus, madal tõendatuse aste |
Sepsise ja septilise šokiga patsiendi infusioonraviga tuleb alustada kohe pärast sündroomi äratundmist. Esmane manustatav vedelik peaks olema isotooniline kristalloidlahus: kas tasakaalustatud (nt Ringeri laktaadilahus) või tasakaalustamata (nt 0,9% NaCl) lahus.
Eesti algses, 2018. aasta ravijuhendis ei soovitanud töörühm sepsise ega septilise šoki vedelikravis eelistada ei tasakaalustatud ega ka tasakaalustamata isotoonilisi kristalloidlahuseid, arvestades, et suremuse vähenemises (32) ega neeruasendusravi vajaduse vähenemises (33) ei leitud esimesel mingit eelist teise ees. Tõendusmaterjali alusel esines tasakaalustatud kristalloidlahuse kasutamisel metaboolse atsidoosi süvenemist oluliselt harvem (RR 1,23; 95% CI 1,13–1,33) kui tasakaalustamata lahuse kasutamisel, samuti esines esimese puhul sagedamini metaboolset alkaloosi (34).
Kahe uuema, ent madala astme tõendatusega süstemaatilise ülevaate ja metaanalüüsi (35, 36) alusel on tasakaalustatud lahuse rühmas aga madalam suremus kui tasakaalustamata lahuse rühmas, samuti oli esimeses rühmas vähem kloriidisisalduse suurenemist ja BE defitsiiti (35, 36). Samas ei leitud rühmades märkimisväärset vahet pH vähenemises ja bikarbonaadi defitsiidis. Samuti ei olnud uuringute alusel neeruasendusravi vajaduse seisukohalt erinevust, kas kasutada tasakaalustatud või tasakaalustamata lahust (35, 36).
Ravijuhendi töörühm otsustas, et arvestades lisandunud tõendusmaterjali, tuleks esmase lahusena eelistada tasakaalustatud kristalloidlahust. Kui tasakaalustamata lahuseid siiski kasutatakse, soovitab töörühm jälgida kloriidisisaldust seerumis või plasmas, et vältida hüperkloreemia teket.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 4 ning 2024. aastal ajakohastatud ravijuhendi kliinilise küsimuse 1 tõendusmaterjali kokkuvõtteid.
Eesti algses, 2018. aasta ravijuhendis ei soovitanud töörühm sepsise ega septilise šoki vedelikravis eelistada ei tasakaalustatud ega ka tasakaalustamata isotoonilisi kristalloidlahuseid, arvestades, et suremuse vähenemises (32) ega neeruasendusravi vajaduse vähenemises (33) ei leitud esimesel mingit eelist teise ees. Tõendusmaterjali alusel esines tasakaalustatud kristalloidlahuse kasutamisel metaboolse atsidoosi süvenemist oluliselt harvem (RR 1,23; 95% CI 1,13–1,33) kui tasakaalustamata lahuse kasutamisel, samuti esines esimese puhul sagedamini metaboolset alkaloosi (34).
Kahe uuema, ent madala astme tõendatusega süstemaatilise ülevaate ja metaanalüüsi (35, 36) alusel on tasakaalustatud lahuse rühmas aga madalam suremus kui tasakaalustamata lahuse rühmas, samuti oli esimeses rühmas vähem kloriidisisalduse suurenemist ja BE defitsiiti (35, 36). Samas ei leitud rühmades märkimisväärset vahet pH vähenemises ja bikarbonaadi defitsiidis. Samuti ei olnud uuringute alusel neeruasendusravi vajaduse seisukohalt erinevust, kas kasutada tasakaalustatud või tasakaalustamata lahust (35, 36).
Ravijuhendi töörühm otsustas, et arvestades lisandunud tõendusmaterjali, tuleks esmase lahusena eelistada tasakaalustatud kristalloidlahust. Kui tasakaalustamata lahuseid siiski kasutatakse, soovitab töörühm jälgida kloriidisisaldust seerumis või plasmas, et vältida hüperkloreemia teket.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 4 ning 2024. aastal ajakohastatud ravijuhendi kliinilise küsimuse 1 tõendusmaterjali kokkuvõtteid.
| 5 |
|
Sepsise, sh septilise šoki esmaseks vedelikraviks pigem ärge kasutage želatiinipreparaate. Nõrk negatiivne soovitus, madal tõendatuse aste |
Sünteetiliste kolloidlahuste ja albumiini eesmärk infusioonravi osana on tagada adekvaatne onkootne rõhk ja intravaskulaarne maht ning vähendada manustatava vedeliku interstitsiaalset leket. Samas on viimaste aastatega selgunud, et albumiini- ja sünteetilised kolloidlahused ei ole ringleva vere mahu taastamiseks patoloogilistes tingimustes nii tõhusad kui varem eeldati. Hüpovoleemia ja sepsise tõttu kahjustunud kapillaarmembraani korral on kõigi veeni manustatud vedelike jaotumine organismis suuresti ennustamatu (25).
Želatiinipreparaatide kasutamise eesmärk oleks vähendada infusioonraviks manustatava kristalloidlahuse kogust ja seeläbi kogu manustatava vedeliku hulka (37, 38). Ravi käigus kujunev positiivne vedelikubilanss on riskitegur edasisteks tüsistusteks: neerukahjustuse süvenemine, kopsude kunstliku ventilatsiooni vajadus ja pikem intensiivraviosakonnas viibimine(39–41). Suurema kumulatiivse positiivse vedelikubilansiga patsientidel on oluliselt suurem suremus (3, 42). Seetõttu võiksid infusioonravis vajalikud olla onkootse rõhuga lahused, sh želatiinipreparaadid.
Želatiinipreparaatide kasutamise kohta sepsise ja septilise šoki ravis puuduvad selgelt positiivse tulemusega juhuslikustatud kontrolluuringud.
Väga madala kvaliteediga süstemaatilisse ülevaatesse ja metaanalüüsi kaasati 60 artiklit, millest 30 olid juhuslikustatud kontrolluuringud, 8 juhuslikustamata uuringud ning 22 loomuuringud. Nendes võrreldi želatiinipreparaate ja isotoonilist kristalloidlahust. Suremuse ega neerukahjustuse esinemisel ei leitud olulist vahet. Üheski analüüsi kaasatud juhuslikustatud uuringus ei uuritud sepsise ja septilise šokiga patsiente (38).
Želatiinipreparaatide kasutamise üks tõsisem võimalik kõrvaltoime on allergiline reaktsioon. Mainitud metaanalüüsi tulemusel oli anafülaksia risk želatiinipreparaatide rühmas palju suurem kui kristalloidlahust või albumiini saanud rühmas (RR 3,01; 95% CI 1,27–7,14) (38). Kristalloidlahuse kasutamisel allergiliste reaktsioonide oht peaaegu puudub. Na- ja Cl-ioonide sisalduse poolest on võrreldavad lahused väga sarnased.
Ravijuhendi töörühm leidis, et želatiinipreparaatidest põhjustatud allergiliste reaktsioonide ja neerukahjustuse tekkeriski ei saa lõplikult välistada. Kasutamist piirab ka lahuste kõrgem hind võrreldes kristalloidlahustega. Seetõttu ei peaks sepsise ja septilise šoki vedelikravis esmase infusioonlahusena želatiinipreparaate kasutama.
Želatiinipreparaatide kasutamise eesmärk oleks vähendada infusioonraviks manustatava kristalloidlahuse kogust ja seeläbi kogu manustatava vedeliku hulka (37, 38). Ravi käigus kujunev positiivne vedelikubilanss on riskitegur edasisteks tüsistusteks: neerukahjustuse süvenemine, kopsude kunstliku ventilatsiooni vajadus ja pikem intensiivraviosakonnas viibimine(39–41). Suurema kumulatiivse positiivse vedelikubilansiga patsientidel on oluliselt suurem suremus (3, 42). Seetõttu võiksid infusioonravis vajalikud olla onkootse rõhuga lahused, sh želatiinipreparaadid.
Želatiinipreparaatide kasutamise kohta sepsise ja septilise šoki ravis puuduvad selgelt positiivse tulemusega juhuslikustatud kontrolluuringud.
Väga madala kvaliteediga süstemaatilisse ülevaatesse ja metaanalüüsi kaasati 60 artiklit, millest 30 olid juhuslikustatud kontrolluuringud, 8 juhuslikustamata uuringud ning 22 loomuuringud. Nendes võrreldi želatiinipreparaate ja isotoonilist kristalloidlahust. Suremuse ega neerukahjustuse esinemisel ei leitud olulist vahet. Üheski analüüsi kaasatud juhuslikustatud uuringus ei uuritud sepsise ja septilise šokiga patsiente (38).
Želatiinipreparaatide kasutamise üks tõsisem võimalik kõrvaltoime on allergiline reaktsioon. Mainitud metaanalüüsi tulemusel oli anafülaksia risk želatiinipreparaatide rühmas palju suurem kui kristalloidlahust või albumiini saanud rühmas (RR 3,01; 95% CI 1,27–7,14) (38). Kristalloidlahuse kasutamisel allergiliste reaktsioonide oht peaaegu puudub. Na- ja Cl-ioonide sisalduse poolest on võrreldavad lahused väga sarnased.
Ravijuhendi töörühm leidis, et želatiinipreparaatidest põhjustatud allergiliste reaktsioonide ja neerukahjustuse tekkeriski ei saa lõplikult välistada. Kasutamist piirab ka lahuste kõrgem hind võrreldes kristalloidlahustega. Seetõttu ei peaks sepsise ja septilise šoki vedelikravis esmase infusioonlahusena želatiinipreparaate kasutama.
Sepsise ja septilise šoki korral albumiinilahuse infusiooni kasutamise võimalike eeliste kohta on avaldatud mõõduka kvaliteediga juhuslikustatud kontrolluuring, mille valimisse kuulusid intensiivravihaiged (43). Uuringusse kaasati 1818 patsienti: albumiini- ja kristalloidlahuse rühma 910 ja ainult kristalloidlahust saavasse rühma 908 patsienti. Ei ilmnenud olulist erinevust 28 päeva suremuses [kristalloidlahus koos albumiiniga 285/895 (31,8%) vs. üksinda 288/900 (32%)] ega ka 90 päeva suremuses [kristalloidlahus koos albumiiniga 365/888 (41,1%) vs. üksinda 389/893 (43,6%)]. Samuti puudus oluline erinevus ägeda neerupuudulikkuse tekkes ja neeruasendusravi vajaduses [kristalloidlahus koos albumiiniga 222/903 (24,6 %) vs. üksinda 194/907 (21,4%)]. Albumiini kasutamise ainus eelis oli mõnevõrra lühem vasopressorite vajadus ning väiksem vedelikuretentsioon. Uuringu puudus on asjaolu, et see on tehtud intensiivraviosakonda hospitaliseeritud patsientide seas ning ei hõlma seega sepsise ja septilise šoki käsitluse esimesi tunde. Tulemuste põhjal võib aga järeldada, et albumiini kasutamine on sepsise ja septilise šokiga patsiendi puhul ohutu (43).
Arvestades albumiini kõrget hinda ja seda, et praeguse teaduskirjanduse analüüsi alusel ei ole albumiinil selget eelist kristalloidlahuse ees, otsustas ravijuhendi töörühm soovitada sepsise ja septilise šoki esmases vedelikravis kasutada kristalloidlahust.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliiniliste küsimuste 2 ja 3 tõendusmaterjali kokkuvõtteid.
Arvestades albumiini kõrget hinda ja seda, et praeguse teaduskirjanduse analüüsi alusel ei ole albumiinil selget eelist kristalloidlahuse ees, otsustas ravijuhendi töörühm soovitada sepsise ja septilise šoki esmases vedelikravis kasutada kristalloidlahust.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliiniliste küsimuste 2 ja 3 tõendusmaterjali kokkuvõtteid.
Antimikroobne ravi
| 6 |
|
Sepsise, sh septilise šoki äratundmisel alustage empiirilist antimikroobset ravi ühe tunni jooksul. Tugev positiivne soovitus, madal tõendatuse aste |
| 7 |
|
Enne empiirilise antimikroobse ravi alustamist tehke verekülvid. Teised mikrobioloogiliseks uuringuks asjakohased proovid (hingamisteede sekreet, uriin, liikvor, pleuravedelik jm) võtke vaid juhul, kui ravi algus selle tõttu ei hiline. Praktiline soovitus |
Antimikroobne ravi on sepsise ja septilise šoki käsitluses tähtis.
Teaduskirjanduses puuduvad juhuslikustatud uuringud, milles võrreldaks antimikroobse ravi alustamist ühe tunni jooksul või hiljem. Enamikus uuringutes analüüsitakse aega esimese antimikroobse ravimi, mitte esimese adekvaatse ravimi annuseni.
Väga madala kvaliteediga metaanalüüsi kaasati kaheksa vaatlusuuringut, millest viis oli tehtud intensiivraviosakonnas ja kolm erakorralise meditsiini osakonnas. Leiti, et suremus vähenes, kui antimikroobset ravi alustati ühe tunni jooksul (OR 0,88; 95% CI 0,81–0,95). Enamikus uuringutes analüüsiti haiglasuremust (9).
Mõõduka kvaliteediga retrospektiivses mitmekeskuselises kohortuuringus, kuhu kaasati 2731 intensiivraviosakonna patsienti, näidati, et iga tund adekvaatse antimikroobse ravi alustamisega hilinemist suurendab šanssi haiglas surra 1,119 korda (95% CI 1,103–1,136) (44).
Väga madala kvaliteediga metaanalüüsi kaasati kaheksa vaatlusuuringut, millest viis oli tehtud intensiivraviosakonnas ja kolm erakorralise meditsiini osakonnas. Leiti, et suremus vähenes, kui antimikroobset ravi alustati ühe tunni jooksul (OR 0,88; 95% CI 0,81–0,95). Enamikus uuringutes analüüsiti haiglasuremust (9).
Mõõduka kvaliteediga retrospektiivses mitmekeskuselises kohortuuringus, kuhu kaasati 2731 intensiivraviosakonna patsienti, näidati, et iga tund adekvaatse antimikroobse ravi alustamisega hilinemist suurendab šanssi haiglas surra 1,119 korda (95% CI 1,103–1,136) (44).
Mõõduka kvaliteediga retrospektiivses kohortuuringus „Surviving Sepsis Campaign“ andmebaasi 17 990 intensiivravi patsiendi puhul leiti, et iga lisatund, mil antibiootikumi manustamisega hilinetakse, suurendab šanssi haiglas surra, vastavalt OR 0–1 h: 1,00; 1–2 h: 1,07 (95% CI 0,97–1,18); 2–3 h: 1,14 (95% CI
1,02–1,26); 3–4 h: 1,19 (95% CI 1,04–1,35); 4–5 h: 1,24 (95% CI 1,06–1,45); 5–6
h: 1,47 (95% CI 1,22–1,76); > 6 h: 1,52 (95% CI 1,36–1,70) (45).
h: 1,47 (95% CI 1,22–1,76); > 6 h: 1,52 (95% CI 1,36–1,70) (45).
Madala kvaliteediga prospektiivses kohortuuringus, kuhu kaasati 4138 patsienti Saksamaa 40 intensiivraviosakonnast, leiti, et iga hilinetud tund antimikroobse ravi alustamisel suurendab 28 päeva suremuse riski 2% (OR 1,02; 95% CI 1,01–
1,03) (46).
Madala kvaliteediga prospektiivses kohortuuringus, kuhu kaasati 1373 patsienti ühest Saksamaa intensiivraviosakonnast, ei leitud statistiliselt olulist seost antibiootikumravi hilinemise ja 90 päeva suremuse vahel, kuid adekvaatne antimikroobne ravi vähendas suremust (HR 0,631; 95% CI 0,53–0,75) (47).
Uuem tõendusmaterjal sepsise ja septilise šokiga patsientide antimikroobse ravi alustamise kiirusest pärines kahest metaanalüüsist (6, 48), ühest klaster- juhuslikustatud kontrolluuringust (49) ja kolmest vaatlusuuringust (50–52). Heterogeenne, väga madala astme tõendusmaterjal näitas, et iga tund antimikroobse raviga hilinemist oli seotud suurema suremusega ning seos oli seda tugevam, mida kauem antimikroobse ravi algus viibis (5, 48–52).
Ravijuhendi töörühm leidis, et laiatoimelise antimikroobse ravimi kergekäeline kasutamine erakorralise meditsiini osakonnas võib soodustada antibiootikumiresistentsuse kujunemist. Soovimatute kõrvaltoimete kohta ei ole eraldi analüüsi tehtud. Varase antimikroobse ravi kahju jääb siiski võimalikule kasule alla, sest raviga hilinemine võib halvendada selle tulemust. Uuem tõendusmaterjal ei mõjutanud töörühma hinnangul algse ravijuhendi soovitust. Kuna olemasolevad andmed pigem näitavad, et adekvaatse antimikroobse ravimi võimalikult varane manustamine vähendab suremust, on mõistlik seda teha esimese tunni jooksul. Töörühm möönab, et kuigi sepsise äratundmise hetke on raske dokumenteerida, on auditeerimisel soovitatav kasutada 3 tunni kriteeriumi alates erakorralise meditsiini osakonda hospitaliseerimisest.
1,03) (46).
Madala kvaliteediga prospektiivses kohortuuringus, kuhu kaasati 1373 patsienti ühest Saksamaa intensiivraviosakonnast, ei leitud statistiliselt olulist seost antibiootikumravi hilinemise ja 90 päeva suremuse vahel, kuid adekvaatne antimikroobne ravi vähendas suremust (HR 0,631; 95% CI 0,53–0,75) (47).
Uuem tõendusmaterjal sepsise ja septilise šokiga patsientide antimikroobse ravi alustamise kiirusest pärines kahest metaanalüüsist (6, 48), ühest klaster- juhuslikustatud kontrolluuringust (49) ja kolmest vaatlusuuringust (50–52). Heterogeenne, väga madala astme tõendusmaterjal näitas, et iga tund antimikroobse raviga hilinemist oli seotud suurema suremusega ning seos oli seda tugevam, mida kauem antimikroobse ravi algus viibis (5, 48–52).
Ravijuhendi töörühm leidis, et laiatoimelise antimikroobse ravimi kergekäeline kasutamine erakorralise meditsiini osakonnas võib soodustada antibiootikumiresistentsuse kujunemist. Soovimatute kõrvaltoimete kohta ei ole eraldi analüüsi tehtud. Varase antimikroobse ravi kahju jääb siiski võimalikule kasule alla, sest raviga hilinemine võib halvendada selle tulemust. Uuem tõendusmaterjal ei mõjutanud töörühma hinnangul algse ravijuhendi soovitust. Kuna olemasolevad andmed pigem näitavad, et adekvaatse antimikroobse ravimi võimalikult varane manustamine vähendab suremust, on mõistlik seda teha esimese tunni jooksul. Töörühm möönab, et kuigi sepsise äratundmise hetke on raske dokumenteerida, on auditeerimisel soovitatav kasutada 3 tunni kriteeriumi alates erakorralise meditsiini osakonda hospitaliseerimisest.
Enne antimikroobse ravi alustamist on vaja kindlasti teha verekülvid. Võimaluse korral tuleb teha ka muud mikrobioloogilised analüüsid (nt uriin, liikvor, mäda, pleuravedelik), kuid vaid eeldusel, et külvide tegemine ei põhjusta antimikroobse raviga hilinemist. Täiskasvanud patsiendile tuleb teha kaks-kolm verekülvi. Üheks verekülviks võetakse verd ühe punktsiooniga, täiskasvanute puhul 20–30 ml. Üheks verekülviks on vaja aeroobse ja anaeroobse söötmega pudelit, invasiivse seeninfektsiooni kahtlusel ka seenesöötmega pudelit. Külviks vajalik veri võetakse eelistatult perifeersete veenide punktsioonil, ajaline intervall ei ole vajalik. Veresoonekateetrist on lubatud võtta verd vahetult pärast uue kateetri sisestamist, kuid peab arvestama suurema saastumisriskiga. Patsiendi puhul, kellel kahtlustatakse veresoonekateetriga seotud vereringeinfektsiooni, tuleb saata külviks laborisse veresoonekateetri ots ja võtta lisaks eraldi punktsiooni teel verekülviks vajalik veri (53).
Empiirilist antimikroobset ravi tuleks alustada preparaadi või preparaatide kombinatsiooniga, mis toimib kõigi tõenäoliste haigustekitajate vastu ja mis sobivas kontsentratsioonis jõuab arvatavasse infektsioonikoldesse. Konkreetse ravimi valikul tuleb lähtuda iga haigla empiirilise antimikroobse ravi juhendist ja infektsiooni paikmest.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 13 ning 2024. aastal ajakohastatud ravijuhendi kliinilise küsimuse 4 tõendusmaterjali kokkuvõtteid.
Empiirilist antimikroobset ravi tuleks alustada preparaadi või preparaatide kombinatsiooniga, mis toimib kõigi tõenäoliste haigustekitajate vastu ja mis sobivas kontsentratsioonis jõuab arvatavasse infektsioonikoldesse. Konkreetse ravimi valikul tuleb lähtuda iga haigla empiirilise antimikroobse ravi juhendist ja infektsiooni paikmest.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 13 ning 2024. aastal ajakohastatud ravijuhendi kliinilise küsimuse 4 tõendusmaterjali kokkuvõtteid.
| 8 |
|
Sepsise, sh septilise šokiga neutropeenilise patsiendi empiirilises ravis pigem ärge kasutage kahe antibiootikumi kombinatsiooni. Nõrk negatiivne soovitus, madal tõendatuse aste |
| 9 |
|
Sepsise, sh septilise šokiga neutropeenilise patsiendi empiirilises ravis kasutage kahe antibiootikumi kombi- natsiooni juhul, kui patsiendil on varem esinenud koloni- seeritust või infektsioone multiresistentsete gramnegatiivsete mikroorganismidega. Praktiline soovitus |
- kombineeritud antimikroobne ravi, mis toimib ühe mikroobi vastu;
- laiendatud toimespektriga antimikroobne ravi, mis toimib eri mikroo- bide vastu (vt mõisted).
Sepsise või septilise šokiga neutropeeniliste patsientide suremus võib olenevalt seisundi raskusastmest ulatuda 35–85%-ni (54). Neutropeenilistel patsientidel domineerivad vereringeinfektsioonide tekitajana gramnegatiivsed bakterid. Viimase kümnendi jooksul on sagenenud infektsioonid, mille on põhjustanud multiresistentsed tekitajad (55, 56).
Beetalaktaamantibiootikumi kombineerimine aminoglükosiidi, fluorokinolooni või kolistiiniga on näidustatud, kui probleem on multiresistentsed gramnegatiivsed tekitajad (nt Pseudomonas sp., Acinetobacter sp. või karbapeneemiresistentne enterobakter). Eestis on üksikutel juhtudel verekülvidest isoleeritud multi- resistentseid Acinetobacter sp. ning karbapeneemiresistentseid enterobaktereid (57).
Sepsise ja septilise šokiga neutropeeniliste patsientide seas ei ole tehtud juhuslikustatud kliinilisi uuringuid, et võrrelda kombinatsioonravi monoteraapiaga. Seetõttu on siinse ravijuhendi tõendusmaterjali kaasatud eraldi uuringuid nii neutropeeniliste kui ka sepsise ja septilise šokiga patsientide kohta.
Mõõduka kvaliteediga süstemaatilise ülevaate ja metaanalüüsi alarühmauuringus võrreldi sama beetalaktaamantibiootikumi monoteraapiat ja kombinatsioonravi aminoglükosiidiga. Analüüsi kaasati 11 juhuslikustatud uuringut, milles osales kokku 1718 neutropeenilist pahaloomulise kasvajaga patsienti. Rühmade suremuses ei ilmnenud olulist vahet (58).
Väga madala kvaliteediga süstemaatilise ülevaate ja metaanalüüsi ala- rühmauuringus võrreldi sama beetalaktaamantibiootikumi monoteraapiat ja aminoglükosiidiga kombinatsioonravi. Kaasati 13 juhuslikustatud uuringut ja 1431 sepsisega patsienti. Ka selles uuringus ei leitud suremuses statistiliselt olulist erinevust (59).
Mõõduka kvaliteediga süstemaatilises ülevaates ja metaanalüüsis, kuhu kaasati 13 juhuslikustatud uuringut ning 2633 raske sepsisega patsienti, ei leitud erinevust suremuses. Mõnes analüüsi kaasatud uuringus võrreldi eri beetalaktaamantibiootikume (60).
Ühes Hispaania intensiivraviosakonnas tehtud madala kvaliteediga retrospektiivses kohortuuringus ei leitud vahet 7, 15 ja 30 päeva suremuses 576 septilise šokiga patsiendi seas, kui analüüsiti kogu rühma tulemusi. Küll aga oli 69 neutropeenilisel patsiendil statistiliselt oluliselt väiksem šanss surra kombinatsioonrühmas 15. päeval (OR 0,29; 95% CI 0,09–0,92) ja 30. päeval (OR 0,25; 95% CI 0,08–0,79) (61).
Kahes Hollandi intensiivraviosakonnas tehtud väga madala kvaliteediga prospektiivses kohortuuringus kombineeriti III põlvkonna tsefalosporiini gentamütsiiniga. Raske sepsise ja septilise šokiga 648 patsiendil ei esinenud erinevust 14 päeva suremuses (62).
Väga madala kvaliteediga retrospektiivses mitmekeskuselises kohortuuringus, milles uuriti eri kombinatsioonravivariante (beetalaktaamantibiootikum või vankomütsiin ning aminoglükosiid või fluorokinoloon või klindamütsiin), vähenes kombinatsioonravi korral bakteriaalse septilise šokiga patsientidel 28 päeva suremus statistiliselt olulisel määral (HR 0,77; 95% CI 0,67–0,88) (63).
Madala kvaliteediga süstemaatilisse ülevaatesse ja metaanalüüsi kaasati nii retrospektiivsed ja prospektiivsed kohortuuringud kui ka juhuslikustatud uuringud (kokku 50). Koguvalimi analüüsis ei esinenud erinevust suremuses, kui võrreldi kombinatsioonravi ja monoteraapiat. Kui eraldi analüüsiti monoteraapiarühma patsiente, kelle suremuse risk oli < 15% , leiti, et neil oli statistiliselt oluliselt suurem šanss surra kombinatsioonravi korral (OR 1,53; 95% CI 1,16–2,03). Septilise šokiga patsientide alarühma uuringus, kuhu kaasati 12 vaatlusuuringut, leiti aga, et kombinatsioonravi vähendas oluliselt šanssi surra (OR 0,51; 95% CI 0,36–0,72) (64).
Uuringutes on ka näidatud, et nii neutropeenilistel pahaloomulise kasvajaga kui ka sepsisega patsientidel suurenes kombinatsioonravi korral nefrotoksilisus statistiliselt olulisel määral (58, 59). Gentamütsiini manustamine põhjustas septilise šokiga patsientidel neerupuudulikkust (62).
Ravijuhendi töörühm leidis, et seda küsimust puudutav tõendusmaterjal on kaudne ja mitmeti tõlgendatav. Ravijuhendi ajakohastamise käigus uuemat teemakohast tõendusmaterjali ei leitud. Kombinatsioonravi eeliseid monoteraapia ees ei ole suremuse vähendamise seisukohast veenvalt tõestatud. Samas oleks kombinatsioonraviga patsiendil suurem risk ravimi kõrvaltoimete tekkeks, samuti kaasnevad kombinatsioonraviga suuremad ravikulud (ravimite maksumus, vajadus aminoglükosiidide kontsentratsiooni määramiseks seerumis) (9). Seetõttu otsustas töörühm soovitada sepsise ja septilise šokiga neutropeenilise patsiendi empiirilises ravis mitte kasutada kahe antibakteriaalse ravimi kombinatsiooni. Kuna ebavõrdsesse seisu võivad jääda patsiendid, kelle infektsiooni on siiski põhjustanud multiresistentne gramnegatiivne tekitaja ning kellel võimaldaks empiiriline kombineeritud ravi suurema tõenäosusega haigustekitaja vastu toimida, otsustas töörühm sõnastada ka praktilise soovituse.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 14 ning 2024. aastal ajakohastatud ravijuhendi kliinilise küsimuse 5 tõendusmaterjali kokkuvõtteid.
Beetalaktaamantibiootikumi kombineerimine aminoglükosiidi, fluorokinolooni või kolistiiniga on näidustatud, kui probleem on multiresistentsed gramnegatiivsed tekitajad (nt Pseudomonas sp., Acinetobacter sp. või karbapeneemiresistentne enterobakter). Eestis on üksikutel juhtudel verekülvidest isoleeritud multi- resistentseid Acinetobacter sp. ning karbapeneemiresistentseid enterobaktereid (57).
Sepsise ja septilise šokiga neutropeeniliste patsientide seas ei ole tehtud juhuslikustatud kliinilisi uuringuid, et võrrelda kombinatsioonravi monoteraapiaga. Seetõttu on siinse ravijuhendi tõendusmaterjali kaasatud eraldi uuringuid nii neutropeeniliste kui ka sepsise ja septilise šokiga patsientide kohta.
Mõõduka kvaliteediga süstemaatilise ülevaate ja metaanalüüsi alarühmauuringus võrreldi sama beetalaktaamantibiootikumi monoteraapiat ja kombinatsioonravi aminoglükosiidiga. Analüüsi kaasati 11 juhuslikustatud uuringut, milles osales kokku 1718 neutropeenilist pahaloomulise kasvajaga patsienti. Rühmade suremuses ei ilmnenud olulist vahet (58).
Väga madala kvaliteediga süstemaatilise ülevaate ja metaanalüüsi ala- rühmauuringus võrreldi sama beetalaktaamantibiootikumi monoteraapiat ja aminoglükosiidiga kombinatsioonravi. Kaasati 13 juhuslikustatud uuringut ja 1431 sepsisega patsienti. Ka selles uuringus ei leitud suremuses statistiliselt olulist erinevust (59).
Mõõduka kvaliteediga süstemaatilises ülevaates ja metaanalüüsis, kuhu kaasati 13 juhuslikustatud uuringut ning 2633 raske sepsisega patsienti, ei leitud erinevust suremuses. Mõnes analüüsi kaasatud uuringus võrreldi eri beetalaktaamantibiootikume (60).
Ühes Hispaania intensiivraviosakonnas tehtud madala kvaliteediga retrospektiivses kohortuuringus ei leitud vahet 7, 15 ja 30 päeva suremuses 576 septilise šokiga patsiendi seas, kui analüüsiti kogu rühma tulemusi. Küll aga oli 69 neutropeenilisel patsiendil statistiliselt oluliselt väiksem šanss surra kombinatsioonrühmas 15. päeval (OR 0,29; 95% CI 0,09–0,92) ja 30. päeval (OR 0,25; 95% CI 0,08–0,79) (61).
Kahes Hollandi intensiivraviosakonnas tehtud väga madala kvaliteediga prospektiivses kohortuuringus kombineeriti III põlvkonna tsefalosporiini gentamütsiiniga. Raske sepsise ja septilise šokiga 648 patsiendil ei esinenud erinevust 14 päeva suremuses (62).
Väga madala kvaliteediga retrospektiivses mitmekeskuselises kohortuuringus, milles uuriti eri kombinatsioonravivariante (beetalaktaamantibiootikum või vankomütsiin ning aminoglükosiid või fluorokinoloon või klindamütsiin), vähenes kombinatsioonravi korral bakteriaalse septilise šokiga patsientidel 28 päeva suremus statistiliselt olulisel määral (HR 0,77; 95% CI 0,67–0,88) (63).
Madala kvaliteediga süstemaatilisse ülevaatesse ja metaanalüüsi kaasati nii retrospektiivsed ja prospektiivsed kohortuuringud kui ka juhuslikustatud uuringud (kokku 50). Koguvalimi analüüsis ei esinenud erinevust suremuses, kui võrreldi kombinatsioonravi ja monoteraapiat. Kui eraldi analüüsiti monoteraapiarühma patsiente, kelle suremuse risk oli < 15% , leiti, et neil oli statistiliselt oluliselt suurem šanss surra kombinatsioonravi korral (OR 1,53; 95% CI 1,16–2,03). Septilise šokiga patsientide alarühma uuringus, kuhu kaasati 12 vaatlusuuringut, leiti aga, et kombinatsioonravi vähendas oluliselt šanssi surra (OR 0,51; 95% CI 0,36–0,72) (64).
Uuringutes on ka näidatud, et nii neutropeenilistel pahaloomulise kasvajaga kui ka sepsisega patsientidel suurenes kombinatsioonravi korral nefrotoksilisus statistiliselt olulisel määral (58, 59). Gentamütsiini manustamine põhjustas septilise šokiga patsientidel neerupuudulikkust (62).
Ravijuhendi töörühm leidis, et seda küsimust puudutav tõendusmaterjal on kaudne ja mitmeti tõlgendatav. Ravijuhendi ajakohastamise käigus uuemat teemakohast tõendusmaterjali ei leitud. Kombinatsioonravi eeliseid monoteraapia ees ei ole suremuse vähendamise seisukohast veenvalt tõestatud. Samas oleks kombinatsioonraviga patsiendil suurem risk ravimi kõrvaltoimete tekkeks, samuti kaasnevad kombinatsioonraviga suuremad ravikulud (ravimite maksumus, vajadus aminoglükosiidide kontsentratsiooni määramiseks seerumis) (9). Seetõttu otsustas töörühm soovitada sepsise ja septilise šokiga neutropeenilise patsiendi empiirilises ravis mitte kasutada kahe antibakteriaalse ravimi kombinatsiooni. Kuna ebavõrdsesse seisu võivad jääda patsiendid, kelle infektsiooni on siiski põhjustanud multiresistentne gramnegatiivne tekitaja ning kellel võimaldaks empiiriline kombineeritud ravi suurema tõenäosusega haigustekitaja vastu toimida, otsustas töörühm sõnastada ka praktilise soovituse.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 14 ning 2024. aastal ajakohastatud ravijuhendi kliinilise küsimuse 5 tõendusmaterjali kokkuvõtteid.
| 10 |
|
Sepsise, sh septilise šokiga neutropeenilisel patsiendil, kelle neutropeenia põhjuseks on pahaloomuline kasvaja, hematoloogiline haigus või nende ravi, peaks koos antibiootikumidega alustama ka empiirilist seenevastast ravi. Nõrk positiivne soovitus, madal tõendatuse aste |
Sepsise ja septilise šokiga patsientidel võib esineda leukopeenia. Tähtis on nende hulgas eristada immuunpuudulikke raske neutropeeniaga patsiente (neutrofiile ≤ 0,5 × 109/L), kellel on suurem risk seeninfektsiooni haigestuda.
Hematoloogilise kasvaja või siirdatud elundiga patsientidel on seeninfektsioonidest kõige sagedasem invasiivne aspergilloos, kuid intensiivravipatsientide seas esineb rohkem invasiivset kandidoosi. Viimase riskitegurite hulka kuuluvad pahaloomuline hematoloogiline kasvaja, neutropeenia, kemoteraapia, hiljutine kõhuõõneoperatsioon, nekrotiseeriv pankreatiit, neerupuudulikkus, maksatsirroos, diabeet, tsentraalveenikateeter, laiatoimeline antibakteriaalne ravi, immuunsupresseerivad ravimid, totaalne parenteraalne toitmine, pikaajaline intensiivraviosakonnas viibimine ja mitmepaikmeline Candida sp. kolonisatsioon. Intensiivravipatsientide invasiivse kandidoosi ja aspergilloosi haiglasuremus varieerub 17–98%-ni olenevalt põhi- ja kaasuvatest haigustest, infektsiooni raskusastmest, ravi õigeaegsest alustamisest ning infektsioonikolde kontrollist (65–68).
Tõendusmaterjali otsingul ei leitud juhuslikustatud kliinilisi uuringuid, milles hinnataks empiirilise seenevastase ravi alustamise mõju sepsises ja septilises šokis neutropeeniaga patsientide suremusele. Uuringutes käsitleti vaid neutropeeniaga patsiente, kelle kaasuv haigus on pahaloomuline kasvaja või hematoloogiline haigus.
Madala kvaliteediga süstemaatilise ülevaate ja metaanalüüsi põhjal, kuhu kaasati 6 juhuslikustatud uuringut ning 955 palaviku ja neutropeeniaga kasvajahaiget, ei vähendanud empiiriline seenevastane ravi suremust. Küll aga vähenes märkimisväärselt haigestumus invasiivsesse seeninfektsiooni (RR 0,25; 95% CI 0,12–0,54; 5 uuringut ja 800 patsienti) ning infektsiooniga seotud suremus (RR 0,18; 95% CI 0,05–0,71; 4 uuringut) (69).
Väga madala kvaliteediga võrgustik-metaanalüüsis, kuhu kaasati 15 juhuslikustatud uuringut (10 uuringurühma, 4225 hematoloogilise haiguse või pahaloomulise kasvajaga patsienti), võrreldi seenevastaseid ravimeid. Leiti, et empiiriline seenevastane ravi ei mõjuta üldsuremust. 10 uuringu (9 uuringurühma, 2747 patsienti) vaatlus samas metaanalüüsis aga näitas, et seenevastase ravi puudumine (SRP) vähendab infektsiooniga seotud elumust võrreldes eri seenevastaste ravimitega (SRP vs. amfoteritsiin lipiid-kompleks: OR 0,00, 95% CI 0–0,58; SRP vs. amfoteritsiin: B OR 0, 95% CI 0–0,11; SRP vs. liposomaalne amfoteritsiin: B OR 0, 95% CI 0–0,05; SRP vs. itrakonasool: OR 0, 95% CI 0–0,09). SRP ja vorikonasooli võrduses suurenes infektsiooniga seotud suremus (OR 1,67 × 109; 95% CI 25,88–4,12 × 1026) (70).
Ravijuhendi „Surviving sepsis campaign“ tõendusmaterjali väga madala kvaliteediga metaanalüüsi kaasati 5 vaatlusuuringut ja 805 patsienti. Leiti, et invasiivse kandidoosiga patsientide empiiriline seenevastane ravi vähendab haiglasuremust (OR 0,22; 95% CI 0,08–0,59). Nendest uuringutest neljas käsitleti invasiivse kandidoosiga patsiente ja ainult ühes empiirilist vs. külvipõhist seenevastast ravi intraabdominaalse sepsisega (püsiv SIRS) patsientide seas. Neutropeeniliste patsientide osakaal (9–19%) oli toodud vaid kahes uuringus. Raske sepsise või septilise šokiga patsientide osakaal (23–100%) oli märgitud kolmes uuringus (66, 71–74).
Tõendusmaterjal on kaudne, sest kõik uuritud patsiendid ei olnud septilises šokis.
Ravijuhendi töörühm leidis, et ilma sepsise või septilise šokita neutropeenilistel (sh febriilse neutropeeniaga) patsientidel ei pea kohe empiirilist seenevastast ravi rakendama. Tõendusmaterjal näitas, et pahaloomulise kasvaja või hematoloogilise haigusega neutropeenilistel patsientidel vähendab empiiriline seeneravi haigestumust invasiivsesse seeninfektsiooni ning infektsiooniga seotud suremust. Sellistel patsientidel tuleks seega sepsise ja septilise šoki empiirilises ravis koos antibiootikumidega rakendada ka seenevastast ravi.
Hematoloogilise kasvaja või siirdatud elundiga patsientidel on seeninfektsioonidest kõige sagedasem invasiivne aspergilloos, kuid intensiivravipatsientide seas esineb rohkem invasiivset kandidoosi. Viimase riskitegurite hulka kuuluvad pahaloomuline hematoloogiline kasvaja, neutropeenia, kemoteraapia, hiljutine kõhuõõneoperatsioon, nekrotiseeriv pankreatiit, neerupuudulikkus, maksatsirroos, diabeet, tsentraalveenikateeter, laiatoimeline antibakteriaalne ravi, immuunsupresseerivad ravimid, totaalne parenteraalne toitmine, pikaajaline intensiivraviosakonnas viibimine ja mitmepaikmeline Candida sp. kolonisatsioon. Intensiivravipatsientide invasiivse kandidoosi ja aspergilloosi haiglasuremus varieerub 17–98%-ni olenevalt põhi- ja kaasuvatest haigustest, infektsiooni raskusastmest, ravi õigeaegsest alustamisest ning infektsioonikolde kontrollist (65–68).
Tõendusmaterjali otsingul ei leitud juhuslikustatud kliinilisi uuringuid, milles hinnataks empiirilise seenevastase ravi alustamise mõju sepsises ja septilises šokis neutropeeniaga patsientide suremusele. Uuringutes käsitleti vaid neutropeeniaga patsiente, kelle kaasuv haigus on pahaloomuline kasvaja või hematoloogiline haigus.
Madala kvaliteediga süstemaatilise ülevaate ja metaanalüüsi põhjal, kuhu kaasati 6 juhuslikustatud uuringut ning 955 palaviku ja neutropeeniaga kasvajahaiget, ei vähendanud empiiriline seenevastane ravi suremust. Küll aga vähenes märkimisväärselt haigestumus invasiivsesse seeninfektsiooni (RR 0,25; 95% CI 0,12–0,54; 5 uuringut ja 800 patsienti) ning infektsiooniga seotud suremus (RR 0,18; 95% CI 0,05–0,71; 4 uuringut) (69).
Väga madala kvaliteediga võrgustik-metaanalüüsis, kuhu kaasati 15 juhuslikustatud uuringut (10 uuringurühma, 4225 hematoloogilise haiguse või pahaloomulise kasvajaga patsienti), võrreldi seenevastaseid ravimeid. Leiti, et empiiriline seenevastane ravi ei mõjuta üldsuremust. 10 uuringu (9 uuringurühma, 2747 patsienti) vaatlus samas metaanalüüsis aga näitas, et seenevastase ravi puudumine (SRP) vähendab infektsiooniga seotud elumust võrreldes eri seenevastaste ravimitega (SRP vs. amfoteritsiin lipiid-kompleks: OR 0,00, 95% CI 0–0,58; SRP vs. amfoteritsiin: B OR 0, 95% CI 0–0,11; SRP vs. liposomaalne amfoteritsiin: B OR 0, 95% CI 0–0,05; SRP vs. itrakonasool: OR 0, 95% CI 0–0,09). SRP ja vorikonasooli võrduses suurenes infektsiooniga seotud suremus (OR 1,67 × 109; 95% CI 25,88–4,12 × 1026) (70).
Ravijuhendi „Surviving sepsis campaign“ tõendusmaterjali väga madala kvaliteediga metaanalüüsi kaasati 5 vaatlusuuringut ja 805 patsienti. Leiti, et invasiivse kandidoosiga patsientide empiiriline seenevastane ravi vähendab haiglasuremust (OR 0,22; 95% CI 0,08–0,59). Nendest uuringutest neljas käsitleti invasiivse kandidoosiga patsiente ja ainult ühes empiirilist vs. külvipõhist seenevastast ravi intraabdominaalse sepsisega (püsiv SIRS) patsientide seas. Neutropeeniliste patsientide osakaal (9–19%) oli toodud vaid kahes uuringus. Raske sepsise või septilise šokiga patsientide osakaal (23–100%) oli märgitud kolmes uuringus (66, 71–74).
Tõendusmaterjal on kaudne, sest kõik uuritud patsiendid ei olnud septilises šokis.
Ravijuhendi töörühm leidis, et ilma sepsise või septilise šokita neutropeenilistel (sh febriilse neutropeeniaga) patsientidel ei pea kohe empiirilist seenevastast ravi rakendama. Tõendusmaterjal näitas, et pahaloomulise kasvaja või hematoloogilise haigusega neutropeenilistel patsientidel vähendab empiiriline seeneravi haigestumust invasiivsesse seeninfektsiooni ning infektsiooniga seotud suremust. Sellistel patsientidel tuleks seega sepsise ja septilise šoki empiirilises ravis koos antibiootikumidega rakendada ka seenevastast ravi.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 15 tõendusmaterjali kokkuvõtteid.
Infektsioonikolde kontroll
| 11 |
|
Sepsise, sh septilise šokiga patsiendil proovige saavutada kontroll infektsioonikolde üle võimalikult kiiresti kas kirurgilise saneerimise või perkutaanse dreenimisega. Tugev positiivne soovitus, madal tõendatuse aste |
| 12 |
|
Kirurgiliselt ravitava haiguse korral rakendage infektsiooni- kolde kontroll nii kiiresti kui võimalik:
|
| 13 |
|
Kui haiglas puuduvad infektsioonikolde diagnoosimise ja/ või lahendamise võimalused, saatke patsient kõrgema etapi haiglasse. [UUS 2024] Praktiline soovitus |
Sepsise ja septilise šoki ravis on tähtis infektsioonikolde kontroll. See tähendab mädakolde kirurgilist, perkutaanset või endoskoopilist drenaaži, surnud koemassi kirurgilist eemaldamist, infektsiooni põhjustava võõrkeha eemaldamist, anatoomilise struktuuri dekompressiooni või jätkuva saastumise piiramist.
Ravijuhendis „Surviving sepsis campaign 2016“ soovitatakse infektsioonikolde kontrolli teha nii kiiresti kui võimalik, lähtudes konkreetsest haigusjuhust ja logistilistest võimalustest (3). 12-tunnist ajapiiri on käsitletud kahes järgmises uuringus.Madala kvaliteediga retrospektiivses kohortuuringus, kuhu kaasati 260 kolangiidi ja septilise šokiga patsienti, näidati, et suremus suureneb oluliselt siis, kui biliaarne dekompressioon (ERCP, perkutaanne drenaaž või kirurgia) tehakse 12 tundi või hiljem peale hüpotensiooni teket (OR 3,4; 95% CI 1,12–10,3). Mediaanaeg kolde kontrollini oli ellujäänutel 8,8 tundi ja surnutel 21,5 tundi (p < 0,0001) (75).
Ravijuhendis „Surviving sepsis campaign 2016“ soovitatakse infektsioonikolde kontrolli teha nii kiiresti kui võimalik, lähtudes konkreetsest haigusjuhust ja logistilistest võimalustest (3). 12-tunnist ajapiiri on käsitletud kahes järgmises uuringus.Madala kvaliteediga retrospektiivses kohortuuringus, kuhu kaasati 260 kolangiidi ja septilise šokiga patsienti, näidati, et suremus suureneb oluliselt siis, kui biliaarne dekompressioon (ERCP, perkutaanne drenaaž või kirurgia) tehakse 12 tundi või hiljem peale hüpotensiooni teket (OR 3,4; 95% CI 1,12–10,3). Mediaanaeg kolde kontrollini oli ellujäänutel 8,8 tundi ja surnutel 21,5 tundi (p < 0,0001) (75).
Madala kvaliteediga retrospektiivsesse kohortuuringusse kaasati 121 Vibrio vulnificus’e põhjustatud nekrotiseeriva fastsiidiga patsienti. Leiti, et patsientidel, keda opereeriti 12 tunni jooksul alates diagnoosi saamisest, oli märkimisväärselt väiksem risk surra kui haigetel, keda opereeriti rohkem kui 12 tunni möödumisel (76).
Kõige kiiremini vajavad infektsioonikolde kontrollimist õõnesorgani perforatsiooniga patsiendid.
Madala kvaliteediga prospektiivses jälgimisuuringus, kuhu kaasati õõnesorgani (jämesool, peensool, magu, kaksteistsõrmiksool) perforatsiooniga 154 septilises šokis patsienti, vaadeldi kolde kontrollimise aja mõju 60 päeva suremusele. Leiti, et suremus suureneb oluliselt haigetel, kelle operatsiooniga viivitatakse (kohandatud OR 0,31 (tunni viivituse kohta); 95% CI 0,19–0,45). Keskmine aeg kirurgiani oli ellujäänutel 2,6 ± 1 tundi ja surnutel 4,6 ± 1,6 tundi (p < 0,00001) (77).
Madala kvaliteediga prospektiivses kohortuuringus, kuhu kaasati 2668 patsienti peptilise haavandi perforatsiooniga, leiti, et iga viivitatud tund kirurgiani suurendab 30 päeva suremust: kui kirurgia tehti ühe tunni jooksul oli elumus 95,7%, kui kolme tunni jooksul, siis 81,8% ning seitsme tunni möödudes 50,0% (78).
Sarnased tulemused saadi ka väga madala kvaliteediga retrospektiivses kohortuuringus, kuhu kaasati 197 valdavalt jämesoolest lähtunud infektsiooni- koldega patsienti. Leiti, et kui aeg kolde kontrollini ületab kuus tundi, on suremus tunduvalt suurem (9% vs. 27%, p = 0,04) (79).
Väga madala kvaliteediga prospektiivses mitmekeskuselises kohortuuringus, millesse kaasati 422 patsienti, näidati, et haigetel, kelle puhul kulus kolde kontrollini kuus tundi või rohkem, oli suurem 28 päeva suremus (42,9% vs. 26,7%, p < 0,001) (80).
Teistsugune tulemus saadi väga madala kvaliteediga retrospektiivses uuringus, kuhu kaasati 76 haiget, kel oli radioloogiliselt diagnoositud õõnesorgani perforatsioon ja septiline šokk. Võrreldi kolde kontrollini kuluvat aega (kuni 3 h vs. 3–9 h vs. üle 9 h) ja leiti, et statistiliselt olulist erinevust haiglasuremuses või haiglaravi kestuses ei olnud (81).
Kõige kiiremini vajavad infektsioonikolde kontrollimist õõnesorgani perforatsiooniga patsiendid.
Madala kvaliteediga prospektiivses jälgimisuuringus, kuhu kaasati õõnesorgani (jämesool, peensool, magu, kaksteistsõrmiksool) perforatsiooniga 154 septilises šokis patsienti, vaadeldi kolde kontrollimise aja mõju 60 päeva suremusele. Leiti, et suremus suureneb oluliselt haigetel, kelle operatsiooniga viivitatakse (kohandatud OR 0,31 (tunni viivituse kohta); 95% CI 0,19–0,45). Keskmine aeg kirurgiani oli ellujäänutel 2,6 ± 1 tundi ja surnutel 4,6 ± 1,6 tundi (p < 0,00001) (77).
Madala kvaliteediga prospektiivses kohortuuringus, kuhu kaasati 2668 patsienti peptilise haavandi perforatsiooniga, leiti, et iga viivitatud tund kirurgiani suurendab 30 päeva suremust: kui kirurgia tehti ühe tunni jooksul oli elumus 95,7%, kui kolme tunni jooksul, siis 81,8% ning seitsme tunni möödudes 50,0% (78).
Sarnased tulemused saadi ka väga madala kvaliteediga retrospektiivses kohortuuringus, kuhu kaasati 197 valdavalt jämesoolest lähtunud infektsiooni- koldega patsienti. Leiti, et kui aeg kolde kontrollini ületab kuus tundi, on suremus tunduvalt suurem (9% vs. 27%, p = 0,04) (79).
Väga madala kvaliteediga prospektiivses mitmekeskuselises kohortuuringus, millesse kaasati 422 patsienti, näidati, et haigetel, kelle puhul kulus kolde kontrollini kuus tundi või rohkem, oli suurem 28 päeva suremus (42,9% vs. 26,7%, p < 0,001) (80).
Teistsugune tulemus saadi väga madala kvaliteediga retrospektiivses uuringus, kuhu kaasati 76 haiget, kel oli radioloogiliselt diagnoositud õõnesorgani perforatsioon ja septiline šokk. Võrreldi kolde kontrollini kuluvat aega (kuni 3 h vs. 3–9 h vs. üle 9 h) ja leiti, et statistiliselt olulist erinevust haiglasuremuses või haiglaravi kestuses ei olnud (81).
Infektsioonikolde üle tuleb saavutada kontroll võimalikult kiiresti, lähtudes haigust põhjustava konkreetse haiguse üldtuntud raviprintsiipidest ja patsiendi üldseisundist. Töörühm leidis, et kui infektsioonikolle on kirurgiliselt ravitav, tuleb seda teha septilise šoki korral 6 tunni jooksul ja sepsise korral 24 tunni jooksul. Kui infektsioonikolde ravi võimalused konkreetses raviasutuses puuduvad, tuleb patsient saata edasi kõrgemasse etapi haiglasse.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 16 tõendusmaterjali kokkuvõtteid.
Koeperfusiooni hindamine
| 14 |
|
Sepsisekahtlusega patsiendil hinnake kapillaartäituvust. [UUS 2024] Praktiline soovitus |
| 15 |
|
Sepsisekahtlusega patsiendil määrake plasma laktaadi- sisaldus ning tehke vähemalt üks kordusanalüüs järgneva kuue tunni jooksul. Praktiline soovitus |
| 16 |
|
Septilise šoki korral võtke ravieesmärgiks kapillaartäituvuse ja laktaadisisalduse normaliseerimine. [AJAKOHASTATUD 2024] Tugev positiivne soovitus, madal tõendatuse aste |
Laktaadi määramine on standardne laborianalüüs, mis on enamasti määratav automaatanalüsaatoril koos happe-aluse tasakaaluga. Laktaadisisalduse suurenemist plasmas võivad põhjustada eri tegurid, sealhulgas koehüpoksia, mis on üks sepsise ja septilise šoki tagajärgedest. Šoki, sh septilise šoki korral tekib muu hulgas ka naha perfusioonihäire, mida saab kergesti jälgida kapillaartäituvuse hindamise abil.
Olenemata sellest, mis laktaadisisalduse suurenemist põhjustab, on see seotud halva ravitulemusega (82). 2018. aasta ravijuhendis anti soovitus juhtida sepsise ravi laktaadisisalduse järgi: see võib anda odava ja hästi kättesaadava võimaluse hinnata koehüpoksiat ning vähendada sepsise tüsistusi, sealhulgas suremust.
Töörühm võttis arvesse madala kvaliteediga metaanalüüsi, kuhu kaasati 336 patsienti. Leiti suremuse oluline vähenemine (RR 0,67; 95% CI 0,53–0,84), kui võrreldi septilise šoki ravi laktaadisisalduse normaliseerimise eesmärgiga ja ilma selle eesmärgita(3).
Olenemata sellest, mis laktaadisisalduse suurenemist põhjustab, on see seotud halva ravitulemusega (82). 2018. aasta ravijuhendis anti soovitus juhtida sepsise ravi laktaadisisalduse järgi: see võib anda odava ja hästi kättesaadava võimaluse hinnata koehüpoksiat ning vähendada sepsise tüsistusi, sealhulgas suremust.
Töörühm võttis arvesse madala kvaliteediga metaanalüüsi, kuhu kaasati 336 patsienti. Leiti suremuse oluline vähenemine (RR 0,67; 95% CI 0,53–0,84), kui võrreldi septilise šoki ravi laktaadisisalduse normaliseerimise eesmärgiga ja ilma selle eesmärgita(3).
Laktaadisisalduse määramise negatiivse mõju kohta ei leitud eraldi analüüsi, kuid kõigi eelduste kohaselt puudub märkimisväärne soovimatu mõju. Lisaks on varem leitud, et raviga saavutatud laktaadisisalduse vähenemine on seotud elumuse paranemisega. See teema on kokku võetud NICE-i 2016. aasta sepsise ravijuhendis, milleks koguti muu hulgas andmeid laktaadisisalduse muutumise tundlikkuse ja spetsiifilisuse kohta suremuse ennustamisel (9).
Soovituse ajakohastamisel püstitas töörühm laktaadisisalduse normaliseerimise kõrval üheks ravieesmärgi võimaluseks veel kapillaartäituvuse normaliseerimise, arvestades, et selle kohta on uuemat tõendusmaterjali. Leiti kaks madala astme tõendatusega juhuslikustatud kontrolluuringut (83, 84) ning üks juhuslikustatud kontrolluuringu (ANDROMEDA-SHOCK) post-hoc-analüüs (85), millest selgus, et ravi juhtimine kapillaartäituvuse normaliseerumise järgi oli seotud vedelikravi väiksema mahuga ja parema SOFA-skooriga 72 tundi pärast juhuslikustamist. See ei resulteerunud aga väiksemas suremuses (välja arvatud alarühm SOFA < 10) ega organipuudulikkuse asendamise vajaduses. Samas ei ole leitud, et kapillaartäituvuse normaliseerumise eesmärgiks seadmine avaldaks kahjulikku mõju patsiendi ravitulemustele võrreldes laktaadi normaliseerumise eesmärgiga. Post-hoc-analüüsi alusel on laktaadisisalduse dünaamika eesmärk seotud halvema prognoosiga nendel patsientidel, kelle kapillaartäituvus on normaliseerunud (85). Uuringusse kaasati intensiivraviosakonna patsiente ning välja jäeti olulised rühmad, sh kirurgilist ravi vajavad, maksatsirroosiga, ARDS-iga ja kaasuva hematoloogilise pahaloomulise haigusega patsiendid. Seepärast ei saa soovitust rakendada kõikide septilises šokis patsientide puhul.
Arvestades lisandunud tõendusmaterjali, otsustas töörühm anda soovituse seada ravieesmärgiks nii kapillaartäituvuse kui ka laktaadisisalduse normaliseerimine.
Ravijuhendi töörühm arutas soovituse sõnastamisel happe-aluse tasakaalu määramise vastuvõetavust patsientidele ja protseduuri ohutust. Arteri punktsioon ei pruugi olla patsiendile vastuvõetav, samuti ei ole see ohutu. Saadav kasu on töörühma hinnangul siiski suurem kui võimalik ebamugavus ja tüsistused. Lisaks peeti tähtsaks mõjutada olukorda, kus hoolimata sellest, et laktaadisisalduse määramine on Eesti haiglates kättesaadav, ei määrata seda sageli koos happe-aluse tasakaaluga (vt 2014. aasta auditit „Sepsise ravi kvaliteet“) (4). Seetõttu otsustati sõnastada praktiline soovitus eesmärgiga parandada plasma laktaadisisalduse määramist sepsises ja septilises šokis patsientidel. Analüüsiks võiks eelistada arteriaalset verd.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 6 ning 2024. aastal ajakohastatud ravijuhendi kliinilise küsimuse 2 tõendusmaterjali kokkuvõtteid.
Soovituse ajakohastamisel püstitas töörühm laktaadisisalduse normaliseerimise kõrval üheks ravieesmärgi võimaluseks veel kapillaartäituvuse normaliseerimise, arvestades, et selle kohta on uuemat tõendusmaterjali. Leiti kaks madala astme tõendatusega juhuslikustatud kontrolluuringut (83, 84) ning üks juhuslikustatud kontrolluuringu (ANDROMEDA-SHOCK) post-hoc-analüüs (85), millest selgus, et ravi juhtimine kapillaartäituvuse normaliseerumise järgi oli seotud vedelikravi väiksema mahuga ja parema SOFA-skooriga 72 tundi pärast juhuslikustamist. See ei resulteerunud aga väiksemas suremuses (välja arvatud alarühm SOFA < 10) ega organipuudulikkuse asendamise vajaduses. Samas ei ole leitud, et kapillaartäituvuse normaliseerumise eesmärgiks seadmine avaldaks kahjulikku mõju patsiendi ravitulemustele võrreldes laktaadi normaliseerumise eesmärgiga. Post-hoc-analüüsi alusel on laktaadisisalduse dünaamika eesmärk seotud halvema prognoosiga nendel patsientidel, kelle kapillaartäituvus on normaliseerunud (85). Uuringusse kaasati intensiivraviosakonna patsiente ning välja jäeti olulised rühmad, sh kirurgilist ravi vajavad, maksatsirroosiga, ARDS-iga ja kaasuva hematoloogilise pahaloomulise haigusega patsiendid. Seepärast ei saa soovitust rakendada kõikide septilises šokis patsientide puhul.
Arvestades lisandunud tõendusmaterjali, otsustas töörühm anda soovituse seada ravieesmärgiks nii kapillaartäituvuse kui ka laktaadisisalduse normaliseerimine.
Ravijuhendi töörühm arutas soovituse sõnastamisel happe-aluse tasakaalu määramise vastuvõetavust patsientidele ja protseduuri ohutust. Arteri punktsioon ei pruugi olla patsiendile vastuvõetav, samuti ei ole see ohutu. Saadav kasu on töörühma hinnangul siiski suurem kui võimalik ebamugavus ja tüsistused. Lisaks peeti tähtsaks mõjutada olukorda, kus hoolimata sellest, et laktaadisisalduse määramine on Eesti haiglates kättesaadav, ei määrata seda sageli koos happe-aluse tasakaaluga (vt 2014. aasta auditit „Sepsise ravi kvaliteet“) (4). Seetõttu otsustati sõnastada praktiline soovitus eesmärgiga parandada plasma laktaadisisalduse määramist sepsises ja septilises šokis patsientidel. Analüüsiks võiks eelistada arteriaalset verd.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 6 ning 2024. aastal ajakohastatud ravijuhendi kliinilise küsimuse 2 tõendusmaterjali kokkuvõtteid.
| 17 |
|
Sepsise, sh septilise šoki korral pigem ärge tehke hüpoper- fusioonist tingitud laktatsidoosi raviks naatriumbikarbonaadi infusiooni. Nõrk negatiivne soovitus, väga madal tõendatuse aste |
| 18 |
|
Naatriumbikarbonaadi kasutamist kaaluge juhul, kui arteriaalse vere pH on alla 7,15, eriti kui metaboolse atsidoosi põhjusena tulevad arvesse teised seisundid peale hüpoper- fusiooni (krooniline neerupuudulikkus, mürgistused jmt). Praktiline soovitus |
Hemodünaamika muutus, neerupuudulikkus ja kudede oksügenisatsioonihäire võivad põhjustada metaboolset atsidoosi. On tähtis teada, kas selle ravimisel naatriumbikarbonaadiga on positiivne mõju sepsisega patsientide suremusele.
Teaduskirjanduses ei ole avaldatud süstemaatilisi ülevaateid, milles hinnataks naatriumbikarbonaadi infusiooni mõju sepsisega ja septilises šokis patsientide elumusele.
Väga madala kvaliteediga kohortuuringus, kuhu kaasati 72 septilises šokis patsienti, võrreldi bikarbonaadi infusiooni mõju 28 päeva suremusele, ventilaatorravi- ja intensiivravipäevade kestusele ja šoki taandumisele (kui süstoolne vererõhk oli > 90 mm Hg ilma vasopressoorse ravita vähemalt 24 tundi). Bikarbonaadi infusiooni manustamist alustati, kui plasma laktaadisisaldus oli suurenenud ja pH väärtus oli < 7,3, ja see lõpetati, kui pH oli arteriaalses veres vahemikus 7,35–7,4. Kontrollrühmale bikarbonaati ei manustatud. Uuringus leiti, et bikarbonaadirühmal oli intensiivraviosakonnas viibitud ja ventilaatorravipäevade arv statistiliselt oluliselt lühem, kuid 28 päeva suremuses ja šoki taandumise ajas statistiliselt olulist vahet ei leitud. Bikarbonaadirühmas esines oluliselt rohkem hüpokaleemiat (16 patsienti vs. 6 patsienti, p = 0,02), kaltsiumi asendusravi vajaduse suhtes statistiliselt olulist vahet ei leitud (86).
Ravijuhendis „Surviving Sepsis Campaign 2016“ ei soovitata kasutada naatriumbikarbonaati hemodünaamika parandamiseks või vasopressorite vajaduse vähendamiseks hüpoperfusioonist tingitud laktatsidoosiga patsientidel, kelle pH arteriaalses veres on ≥ 7,15 (3). Viidatud on kahele juhuslikustatud kontrolluuringule, milles näidati, et naatriumbikarbonaat ei paranda metaboolses atsidoosis patsientide hemodünaamikat ega mõjuta vasopressoorse ravi vajadust võrreldes naatriumkloriidi infusiooniga. Uuringutes oli kokku 24 patsienti, kelle hulgas ei olnud ainult septilises šokis haiged (87, 88).
Teaduskirjanduses ei ole avaldatud süstemaatilisi ülevaateid, milles hinnataks naatriumbikarbonaadi infusiooni mõju sepsisega ja septilises šokis patsientide elumusele.
Väga madala kvaliteediga kohortuuringus, kuhu kaasati 72 septilises šokis patsienti, võrreldi bikarbonaadi infusiooni mõju 28 päeva suremusele, ventilaatorravi- ja intensiivravipäevade kestusele ja šoki taandumisele (kui süstoolne vererõhk oli > 90 mm Hg ilma vasopressoorse ravita vähemalt 24 tundi). Bikarbonaadi infusiooni manustamist alustati, kui plasma laktaadisisaldus oli suurenenud ja pH väärtus oli < 7,3, ja see lõpetati, kui pH oli arteriaalses veres vahemikus 7,35–7,4. Kontrollrühmale bikarbonaati ei manustatud. Uuringus leiti, et bikarbonaadirühmal oli intensiivraviosakonnas viibitud ja ventilaatorravipäevade arv statistiliselt oluliselt lühem, kuid 28 päeva suremuses ja šoki taandumise ajas statistiliselt olulist vahet ei leitud. Bikarbonaadirühmas esines oluliselt rohkem hüpokaleemiat (16 patsienti vs. 6 patsienti, p = 0,02), kaltsiumi asendusravi vajaduse suhtes statistiliselt olulist vahet ei leitud (86).
Ravijuhendis „Surviving Sepsis Campaign 2016“ ei soovitata kasutada naatriumbikarbonaati hemodünaamika parandamiseks või vasopressorite vajaduse vähendamiseks hüpoperfusioonist tingitud laktatsidoosiga patsientidel, kelle pH arteriaalses veres on ≥ 7,15 (3). Viidatud on kahele juhuslikustatud kontrolluuringule, milles näidati, et naatriumbikarbonaat ei paranda metaboolses atsidoosis patsientide hemodünaamikat ega mõjuta vasopressoorse ravi vajadust võrreldes naatriumkloriidi infusiooniga. Uuringutes oli kokku 24 patsienti, kelle hulgas ei olnud ainult septilises šokis haiged (87, 88).
Puudub kvaliteetne tõendusmaterjal selle kohta, kas naatriumbikarbonaadi infusioon mõjutab sepsisega ja septilises šokis patsientide elumust. Ravijuhendi töörühm otsustas, et hüpoperfusioonist tingitud laktatsidoosi korral ei peaks naatriumbikarbonaadi infusiooni rutiinselt kasutama. Manustamist tuleks kaaluda siis, kui arteriaalse vere pH väärtus on < 7,15, eriti juhul, kui metaboolset atsidoosi võivad põhjustada teised seisundid (nt mürgistus ja krooniline neerupuudulikkus).
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 7 tõendusmaterjali kokkuvõtteid.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 7 tõendusmaterjali kokkuvõtteid.
Vasopressoorne ja inotroopne ravi
| 19 |
|
Septilise šoki korral seadke vasopressoorse ravi eesmärgiks keskmine arteriaalne vererõhk (MAP) vähemalt 65 mm Hg. Tugev positiivne soovitus, mõõdukas tõendatuse aste |
Keskmine arteriaalne vererõhk (ingl mean arterial pressure, MAP) on elundite perfusiooni seisukohast kriitilise tähtsusega parameeter, mida arvestatakse vasopressoorse ravimi annuse reguleerimisel. Seniste uuringute kohaselt ei paranda MAP-i tõstmine üle 65 mm Hg hapniku süsteemset transporti, naha mikrotsirkulatsiooni, diureesi ega kõhukoopaelundite perfusiooni (89).
Mõõduka kvaliteediga juhuslikustatud uuringus jagati 776 septilises šokis patsienti vasopressoorse ravi seisukohast kahte rühma: madalama (65–70 mm Hg) ja kõrgema (80 –85 mm Hg) MAP-i eesmärkväärtuse alusel. Esmane tulemusnäitaja oli 28 päeva suremus, milles kahe rühma vahel olulist erinevust ei leitud. Tõsiste kõrvaltoimete (müokardiinfarkt, kodade virvendusarütmia, ventrikulaarne fibrillatsioon/ventrikulaarne tahhükardia), jäsemete isheemia, mesenteriaalisheemia, veritsus) puhul oli oluliselt suurem kodade virvendusarütmia esinemissagedus kõrgema MAP-i eesmärgiga rühmas (26/388 (6,7%) vs. 11/388 (2,8%), p = 0,02). Alarühmaanalüüsis võeti eraldi vaatluse alla arteriaalset hüpertensiooni põdevad patsiendid, kes olid varem tarvitanud vähemalt ühte antihüpertensiivset ravimit. Leiti, et arteriaalset hüpertensiooni põdevad patsiendid vajasid kõrgema MAP-i eesmärgi seadmise korral vähem neeruasendusravi. Madalama ja kõrgema MAP-i eesmärgiga rühmades olid näitajad vastavalt 73/173 (42,2%) ja 53/167 (31,7%), p = 0,046. Samas ei mõjutanud vererõhueesmärgid elumust (90).
Keskmise kvaliteediga juhuslikustatud katseuuringus jagati 118 patsienti MAP-i eesmärkväärtuse alusel kahte rühma: 60–65 mm Hg ja 75–80 mm Hg. Haiglasuremus oli kahes rühmas võrdne. Alarühmaanalüüsis leiti, et üle 75-aastastel patsientidel on madalama MAP-i eesmärgiga rühmas väiksem suremus – 13% vs. 60% (p = 0,03) (91).
Ravijuhendi töörühm nentis, et kõrgema MAP-i eesmärkväärtuse seadmisel pole elumuse paranemist näidatud. Samas on kõrgema vererõhu saavutamiseks vajalik vasopressoorse ravimi suurem annus, mis toob kaasa südame rütmihäirete sagedama esinemise. Ühes uuringus on näidatud, et kõrgema MAP-i eesmärkväärtuse (vähemalt 80 mm Hg) seadmine vähendas neeruasendusravi vajadust antihüpertensiivseid ravimeid tarvitavatel patsientidel. Samas toob selline sekkumine kaasa rohkem südame rütmihäireid. Teises uuringus näidati alarühmade analüüsi tulemusena, et kõrgema MAP-i eesmärk (75–80 mm Hg) toob kaasa eakamate (üle 75-aastaste) patsientide suurema suremuse (90). Kokkuvõttes andis töörühm tugeva soovituse võtta septilise šoki vasopressoorse ravi eesmärgiks MAP vähemalt 65 mm Hg.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 8 tõendusmaterjali kokkuvõtteid.
Mõõduka kvaliteediga juhuslikustatud uuringus jagati 776 septilises šokis patsienti vasopressoorse ravi seisukohast kahte rühma: madalama (65–70 mm Hg) ja kõrgema (80 –85 mm Hg) MAP-i eesmärkväärtuse alusel. Esmane tulemusnäitaja oli 28 päeva suremus, milles kahe rühma vahel olulist erinevust ei leitud. Tõsiste kõrvaltoimete (müokardiinfarkt, kodade virvendusarütmia, ventrikulaarne fibrillatsioon/ventrikulaarne tahhükardia), jäsemete isheemia, mesenteriaalisheemia, veritsus) puhul oli oluliselt suurem kodade virvendusarütmia esinemissagedus kõrgema MAP-i eesmärgiga rühmas (26/388 (6,7%) vs. 11/388 (2,8%), p = 0,02). Alarühmaanalüüsis võeti eraldi vaatluse alla arteriaalset hüpertensiooni põdevad patsiendid, kes olid varem tarvitanud vähemalt ühte antihüpertensiivset ravimit. Leiti, et arteriaalset hüpertensiooni põdevad patsiendid vajasid kõrgema MAP-i eesmärgi seadmise korral vähem neeruasendusravi. Madalama ja kõrgema MAP-i eesmärgiga rühmades olid näitajad vastavalt 73/173 (42,2%) ja 53/167 (31,7%), p = 0,046. Samas ei mõjutanud vererõhueesmärgid elumust (90).
Keskmise kvaliteediga juhuslikustatud katseuuringus jagati 118 patsienti MAP-i eesmärkväärtuse alusel kahte rühma: 60–65 mm Hg ja 75–80 mm Hg. Haiglasuremus oli kahes rühmas võrdne. Alarühmaanalüüsis leiti, et üle 75-aastastel patsientidel on madalama MAP-i eesmärgiga rühmas väiksem suremus – 13% vs. 60% (p = 0,03) (91).
Ravijuhendi töörühm nentis, et kõrgema MAP-i eesmärkväärtuse seadmisel pole elumuse paranemist näidatud. Samas on kõrgema vererõhu saavutamiseks vajalik vasopressoorse ravimi suurem annus, mis toob kaasa südame rütmihäirete sagedama esinemise. Ühes uuringus on näidatud, et kõrgema MAP-i eesmärkväärtuse (vähemalt 80 mm Hg) seadmine vähendas neeruasendusravi vajadust antihüpertensiivseid ravimeid tarvitavatel patsientidel. Samas toob selline sekkumine kaasa rohkem südame rütmihäireid. Teises uuringus näidati alarühmade analüüsi tulemusena, et kõrgema MAP-i eesmärk (75–80 mm Hg) toob kaasa eakamate (üle 75-aastaste) patsientide suurema suremuse (90). Kokkuvõttes andis töörühm tugeva soovituse võtta septilise šoki vasopressoorse ravi eesmärgiks MAP vähemalt 65 mm Hg.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 8 tõendusmaterjali kokkuvõtteid.
| 20 |
|
Septilise šoki korral kasutage vasopressoorse ravi esma- valikuna noradrenaliini. Tugev positiivne soovitus, kõrge tõendatuse aste |
Vasopressoorne ravi on septilise šoki korral oluline, kuna MAP-i normaalsele tasemele tõstmine on vajalik elundite perfusiooni tagamiseks. Praegu kasutusel olevad vasopressorid võib jagada kahte rühma: katehhoolamiinid (noradrenaliin, adrenaliin, dopamiin, fenüülefriin) ja teised preparaadid (eelkõige vasopressiin ja selle derivaadid). Viimase kümnendi enimkasutatavad vasopressorid on noradrenaliin ja dopamiin.
Hea kvaliteediga juhuslikustatud mitmekeskuselises uuringus, kuhu kaasati 1679 šokis patsienti, võrreldi noradrenaliini ja dopamiini vasopressoorse ravi esmavalikuna. Esmane tulemusnäitaja oli 28 päeva suremus ning teisesed tulemid päevade arv ilma organtoetava ravita (sh ventilaatorravipäevade arv, vasopressoorne ja neeruasendusravi) ja kõrvaltoimed (sh rütmihäired, jäseme isheemia, müokardi nekroos). 28 päeva suremuses ja neeruasendusravi vajaduses olulist erinevust ei leitud. Samas leiti oluline erinevus kõrvaltoimetes, täpsemalt südame rütmihäirete puhul. Dopamiinirühmas esines rütmihäireid 24,1%-l ja noradrenaliinirühmas 12,4%-l (p = 0,001) (92).
Hea kvaliteediga juhuslikustatud mitmekeskuselises uuringus, kuhu kaasati 1679 šokis patsienti, võrreldi noradrenaliini ja dopamiini vasopressoorse ravi esmavalikuna. Esmane tulemusnäitaja oli 28 päeva suremus ning teisesed tulemid päevade arv ilma organtoetava ravita (sh ventilaatorravipäevade arv, vasopressoorne ja neeruasendusravi) ja kõrvaltoimed (sh rütmihäired, jäseme isheemia, müokardi nekroos). 28 päeva suremuses ja neeruasendusravi vajaduses olulist erinevust ei leitud. Samas leiti oluline erinevus kõrvaltoimetes, täpsemalt südame rütmihäirete puhul. Dopamiinirühmas esines rütmihäireid 24,1%-l ja noradrenaliinirühmas 12,4%-l (p = 0,001) (92).
Hea kvaliteediga metaanalüüsis võrreldi 11 juhuslikustatud uuringu ravitulemust dopamiini ja noradrenaliiniga. Noradrenaliini saanute rühmas oli väiksem üldsuremus võrreldes dopamiinirühmaga (vastavalt 45,2% ja 50,8%, p = 0,02). Esimeses esines ka vähem südame rütmihäireid (vastavalt 17,9% ja 37,7%, p = 0,00001). Elumuses ei leitud statistiliselt olulist vahet noradrenaliini ja teiste vasopressorite (adrenaliin, fenüülefriin, vasopressiin, terlipressiin) kasutamises (93).
Hea kvaliteediga ülevaateartiklis ei leitud vasopressorite vahel erinevust suremuses. Selgus taas, et noradrenaliini kasutamisel esines vähem südame rütmihäireid kui dopamiini puhul (vastavalt 12,4% ja 26,0%, p = 0,00046) (94).
Ravijuhendi töörühm leidis, et kuigi suremuses vahet ei ole, on uuringutes selgelt näidatud südame rütmihäirete väiksemat esinemissagedust noradrenaliini kasutamisel võrreldes dopamiiniga. Noradrenaliini eelist teiste vasopressoorsete ravimite (fenüülefriin, adrenaliin, vasopressiin) ees leitud ei ole. Vajaduse korral võib noradrenaliini manustada perifeersesse veeni (nt haigla eel), kuid esimesel võimalusel tuleks vasopressoorseks raviks kanüülida tsentraalveen. Samuti peaks niipea kui võimalik kasutama arteriaalse vererõhu otsest monitooringut.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 9 tõendusmaterjali kokkuvõtteid.
Hea kvaliteediga ülevaateartiklis ei leitud vasopressorite vahel erinevust suremuses. Selgus taas, et noradrenaliini kasutamisel esines vähem südame rütmihäireid kui dopamiini puhul (vastavalt 12,4% ja 26,0%, p = 0,00046) (94).
Ravijuhendi töörühm leidis, et kuigi suremuses vahet ei ole, on uuringutes selgelt näidatud südame rütmihäirete väiksemat esinemissagedust noradrenaliini kasutamisel võrreldes dopamiiniga. Noradrenaliini eelist teiste vasopressoorsete ravimite (fenüülefriin, adrenaliin, vasopressiin) ees leitud ei ole. Vajaduse korral võib noradrenaliini manustada perifeersesse veeni (nt haigla eel), kuid esimesel võimalusel tuleks vasopressoorseks raviks kanüülida tsentraalveen. Samuti peaks niipea kui võimalik kasutama arteriaalse vererõhu otsest monitooringut.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 9 tõendusmaterjali kokkuvõtteid.
| 21 |
|
Septilise šoki korral pigem ärge kasutage rutiinselt inotroopset ravi. Nõrk negatiivne soovitus, madal tõendatuse aste |
| 22 |
|
Inotroopset ravi alustage olukordades, kus on tekkinud tõsine kahtlus või on juba tõestatud, et hüpoperfusiooni põhjus on südame vähene minutimaht ja südamelihase vähenenud kontraktiilsus. Praktiline soovitus |
Sepsisega kaasnev müokardi düsfunktsioon on levinud probleem. Organismi esmane kaitsemehhanism on vasaku vatsakese dilatatsioon, perifeerse arteriaalse resistentsuse vähenemine ja tahhükardia, millega suudetakse südamelihase vähenenud kontraktiilsust mingil määral ajutiselt kompenseerida. Seepärast ei teki kohe kudede hüpoperfusiooni tunnuseid. Inotroopne ravi võiks parandada kudede perfusiooni ja olla näidustatud kõigil septilise šokiga patsientidel.
Madala kvaliteediga juhuslikustatud uuringusse kaasati 1341 patsienti, kes jagati 1:1:1-põhimõttel kolme rühma: varajase eesmärgistatud ravi (EGDT) rühm, protokollil põhineva standardse ravi rühm (EGDT-st vähem agressiivne) ning tavaravirühm (ilma etteantud standarditeta). Dobutamiini kasutati EGDT- rühmas tunduvalt enam (vastavalt 8%, 1,1% ja 0,9%). Inotroopse ravi alustamise tingimused olid järgmised: HCT üle 30% (vajaduse korral erütrotsüütide massi ülekanne), CVP üle 8, MAP üle 65 mm Hg ning ScvO2 alla 70%. 60 päeva suremus oli rühmades vastavalt 21,1%, 8,2% ja 18,9%. Statistilist olulist erinevust rühmade vahel ei leitud. Uuringurühmades võrreldi ka neeruasendusravi vajadust. Näitajad EGDT-, muu protokolli ja tavaravirühmas olid vastavalt 3,1%, 6,0% ja 2,8% (p = 0,04). Tulemuse põhjal võib väita, et EGDT, sh inotroobi kasutamine ei too kasu (21).
Madala kvaliteediga mitmekeskuselises uuringus, kuhu kaasati 1600 septilises šokis patsienti, võrreldi varajase eesmärgistatud ravi protokolli ning tavaravi efekti 90 päeva suremusele. Dobutamiini kasutati EGDT-rühmas rohkem kui tavaravirühmas (vastavalt 15,4% ja 2,6%). Inotroopse ravi alustamise kriteerium oli ScvO2 alla 70% tingimustel, et CVP on üle 8 mm Hg, MAP üle 65 mm Hg ning HCT üle 30%. Ei leitud statistiliselt olulist erinevust suremuses ega neeruasendusravi vajaduses (22).
Keskmise kvaliteediga topeltpimedasse juhuslikustatud uuringusse kaasati 516 sepsisepatsienti, kes jagati kahte rühma: ühed said levosimendaani, teised mitte. Esmane tulemusnäitaja oli SOFA-skoor 28 päeva jooksul. Kahe rühma SOFA-skooris ei leitud statistiliselt olulist erinevust. Sama uuringu teisene tulemusnäitaja oli 28 päeva suremus, milles samuti erinevust ei tuvastatud (95).
Ravijuhendi töörühm leidis, et puuduvad otsesed juhuslikustatud uuringud inotroopse ravi rakendamiseks septilise šoki korral. Kõigi septilise šokiga patsientide puhul ei ole inotroopse ravi rakendamine põhjendatud, kuna selle kasu ei ole tõestatud ning kõrvaltoimena võivad esineda südame rütmihäired ja hüpotensioon. Inotroopse ravi näidustuse selgitamiseks on vaja mõõta või hinnata südame minutimahtu ja südamelihase kontraktiilsust. Vähenenud kontraktiilsusest tingitud väikese minutimahu puhul on inotroopne ravi põhjendatud.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 10 tõendusmaterjali kokkuvõtteid.
Madala kvaliteediga mitmekeskuselises uuringus, kuhu kaasati 1600 septilises šokis patsienti, võrreldi varajase eesmärgistatud ravi protokolli ning tavaravi efekti 90 päeva suremusele. Dobutamiini kasutati EGDT-rühmas rohkem kui tavaravirühmas (vastavalt 15,4% ja 2,6%). Inotroopse ravi alustamise kriteerium oli ScvO2 alla 70% tingimustel, et CVP on üle 8 mm Hg, MAP üle 65 mm Hg ning HCT üle 30%. Ei leitud statistiliselt olulist erinevust suremuses ega neeruasendusravi vajaduses (22).
Keskmise kvaliteediga topeltpimedasse juhuslikustatud uuringusse kaasati 516 sepsisepatsienti, kes jagati kahte rühma: ühed said levosimendaani, teised mitte. Esmane tulemusnäitaja oli SOFA-skoor 28 päeva jooksul. Kahe rühma SOFA-skooris ei leitud statistiliselt olulist erinevust. Sama uuringu teisene tulemusnäitaja oli 28 päeva suremus, milles samuti erinevust ei tuvastatud (95).
Ravijuhendi töörühm leidis, et puuduvad otsesed juhuslikustatud uuringud inotroopse ravi rakendamiseks septilise šoki korral. Kõigi septilise šokiga patsientide puhul ei ole inotroopse ravi rakendamine põhjendatud, kuna selle kasu ei ole tõestatud ning kõrvaltoimena võivad esineda südame rütmihäired ja hüpotensioon. Inotroopse ravi näidustuse selgitamiseks on vaja mõõta või hinnata südame minutimahtu ja südamelihase kontraktiilsust. Vähenenud kontraktiilsusest tingitud väikese minutimahu puhul on inotroopne ravi põhjendatud.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 10 tõendusmaterjali kokkuvõtteid.
| 23 |
|
Septilise šoki korral kaaluge noradrenaliinile vasopressiini lisamist, kui noradrenaliini kasutamisega ei ole saavutatud oodatud efekti vereringele. [AJAKOHASTATUD 2024] Nõrk positiivne soovitus, madal tõendatuse aste |
Septilise šoki vasopressoorseks raviks on esimene valik noradrenaliin. Seniste hüpoteeside kohaselt võimaldab vasopressiini või selle derivaatide lisamine vähendada noradrenaliiniannust ja kõrvaltoimeid. On küsitav, kas selline kombinatsioon vähendab ka suremust.
Mõõduka kvaliteediga juhuslikustatud uuringus (VASST) oli vaatluse all 778 septilises šokis patsienti, kes said vasopressoorseks raviks esimese valikuna noradrenaliini. 396 patsiendile lisati kindla noradrenaliiniannuse juures vasopressiin, 382 patsiendi puhul jätkati noradrenaliiniannuse suurendamisega. 28 päeva suremuses vahet ei leitud. Alarühmaanalüüsis jagati patsiendid šoki raskusastme alusel kahte rühma. Klassifikatsiooni aluseks oli noradrenaliini vajadus juhuslikustamise hetkel. Kerge šokk oli tegu siis, kui noradrenaliini vajadus oli 5–14 μg/min, raske šokk üle 15 μg/min korral. Leiti, et kergema šoki puhul vähendab vasopressiini lisamine suremust. Noradrenaliini monoteraapia rühmas oli 28 päeva suremus 35,7% ning noradrenaliini ja vasopressiini kombinatsiooni saanud rühmas 26,5% (p < 0,05) (96).
Mõõduka kvaliteediga juhuslikustatud katseuuringus võrreldi omavahel terlipressiini, vasopressiini ja noradrenaliini. Hüpotensiooni ravis alustati ühega neist ravimitest ja lisati vajaduse korral juurde noradrenaliin. Intensiivravi elumuses vahet ei leitud (97).
Uuem tõendusmaterjal vasopressoorse ravi kombineerimise kohta septilise šokiga patsientide puhul pärines ravijuhendist „Surviving Sepsis Campaign 2021“ (6), ühest metaanalüüsist (98) ja ühest juhuslikustatud kontrolluuringust (99). Madala astme tõendusmaterjal näitas, et vasopressiini ja noradrenaliini kombineerimine võib vähendada suremust ja neeruasendusravi vajadust, kuid samas võib suureneda perifeerse isheemia risk (6, 98, 99).
Võttes siiski arvesse uuemat tõendusmaterjali, otsustas töörühm anda soovituse kaaluda vasopressiini lisamist, kui noradrenaliini kasutamine ei too oodatud efekti. Töörühm möönab, et vasopressiini lisamisel tuleb jälgida patsienti jäsemete distaalse isheemia tekke suhtes.
Mõõduka kvaliteediga juhuslikustatud uuringus (VASST) oli vaatluse all 778 septilises šokis patsienti, kes said vasopressoorseks raviks esimese valikuna noradrenaliini. 396 patsiendile lisati kindla noradrenaliiniannuse juures vasopressiin, 382 patsiendi puhul jätkati noradrenaliiniannuse suurendamisega. 28 päeva suremuses vahet ei leitud. Alarühmaanalüüsis jagati patsiendid šoki raskusastme alusel kahte rühma. Klassifikatsiooni aluseks oli noradrenaliini vajadus juhuslikustamise hetkel. Kerge šokk oli tegu siis, kui noradrenaliini vajadus oli 5–14 μg/min, raske šokk üle 15 μg/min korral. Leiti, et kergema šoki puhul vähendab vasopressiini lisamine suremust. Noradrenaliini monoteraapia rühmas oli 28 päeva suremus 35,7% ning noradrenaliini ja vasopressiini kombinatsiooni saanud rühmas 26,5% (p < 0,05) (96).
Mõõduka kvaliteediga juhuslikustatud katseuuringus võrreldi omavahel terlipressiini, vasopressiini ja noradrenaliini. Hüpotensiooni ravis alustati ühega neist ravimitest ja lisati vajaduse korral juurde noradrenaliin. Intensiivravi elumuses vahet ei leitud (97).
Uuem tõendusmaterjal vasopressoorse ravi kombineerimise kohta septilise šokiga patsientide puhul pärines ravijuhendist „Surviving Sepsis Campaign 2021“ (6), ühest metaanalüüsist (98) ja ühest juhuslikustatud kontrolluuringust (99). Madala astme tõendusmaterjal näitas, et vasopressiini ja noradrenaliini kombineerimine võib vähendada suremust ja neeruasendusravi vajadust, kuid samas võib suureneda perifeerse isheemia risk (6, 98, 99).
Võttes siiski arvesse uuemat tõendusmaterjali, otsustas töörühm anda soovituse kaaluda vasopressiini lisamist, kui noradrenaliini kasutamine ei too oodatud efekti. Töörühm möönab, et vasopressiini lisamisel tuleb jälgida patsienti jäsemete distaalse isheemia tekke suhtes.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 12 ning 2024. aastal ajakohastatud ravijuhendi kliinilise küsimuse 3 tõendusmaterjali kokkuvõtteid.
Kortikosteroidide kasutamine
| 24 |
|
Septilise šoki ravis kaaluge väikeses annuses kortikosteroidide kasutamist. Nõrk positiivne soovitus, madal tõendatuse aste |
Septilise šoki korral kortikosteroidide kasutamist on intensiivravi ajaloos põhjalikult uuritud. Eksperimentaalsetes uuringutes on näidatud, et suure annuse kortikosteroidide kasutamine põletikureaktsiooni allasurumiseks võiks parandada septilises šokis patsientide elumust. Varastes uuringutes keskenduti suure annuse kasutamisele, kuid kõrvaltoimed kaalusid üles võimaliku kasu (100, 101).
Huvi kortikosteroidide väikeses annuses kasutamise vastu tekkis taas pärast hüpotalamuse-hüpofüüsi-neerupealise telje düsfunktsiooni avastamist septilises šokis patsientidel. Düsfunktsiooni esinemissagedus on 40–60% ning see on seotud vähenenud tundlikkusega vasopressoritele ja suremuse suurenemisega (102).
ESICM-i ja SCCM-i 2017. aasta konsensusjuhistes, milles käsitletakse kortikosteroidipuudulikkuse diagnoosimist ja ravi kriitilises seisundis patsientidel, soovitatakse kasutada kortikosteroide juhul, kui septiline šokk ei ole korrigeeritav infusioonraviga ning mõõdukas või vasopressoorse ravimi suure annusega (nõrk positiivne soovitus, madal tõendatuse aste). Hüdrokortisooniannus peaks sel juhul olema alla 400 mg ööpäevas rohkem kui kolme päeva jooksul (103).
Soovitus põhineb madala kvaliteediga metaanalüüsil, millesse kaasati 1444 patsienti. Hüdrokortisooni saanud patsientide 28 päeva suremus oli 291/741 (39,3%) ning platseeborühmas 302/703 (43,0%) (RR 0,88; 95% CI 0,78–0,99) (104).
Keskmise kvaliteediga mitmekeskuselises juhuslikustatud kontrolluuringus (ADRENAL), kuhu kaasati 69 intensiivraviosakonna 3800 septilises šokis patsienti, võrreldi hüdrokortisooni toimet platseeboga. Hüdrokortisooni manustati 200 mg päevas seitsme päeva jooksul püsiinfusioonina. Tegu on seni suurima uuringuga kortikosteroidide manustamise kohta septilises šokis patsientidel. Uuringusse kaasati valikuliselt rasked haiged, kes vajasid enne uuringut kopsude kunstlikku ventilatsiooni ja üle nelja tunni vasopressoorset ravi. Leiti, et võrreldes platseeboga ei vähendanud hüdrokortisooni kasutamine 90 päeva suremust – hüdrokortisooni saanud patsientide suremus oli 511/1832 (27,9%), kontrollrühmas 526/1826 (28,8%) (OR 0,95; 95% CI 0,82–1,10). Efekt puudus ka alarühmade analüüsimisel. Samas lahenes hüdrokortisooni saanud patsientidel šokk kiiremini (mediaanaeg 3 (2–5) vs. 4 (2–9) päeva, p < 0,001) ja vähenes erütrotsüütide ülekande vajadus (37,0% vs. 41,7%, p = 0,004); lühenes intensiivraviosakonnas viibimise aeg (mediaanaeg 10 (5–30) vs. 12 (6–42) päeva, p < 0,001) ning sai varem lõpetada kopsude kunstliku ventilatsiooni esimese episoodi. Ventilaatorravipäevade arvus rühmade vahel erinevust ei leitud (mediaanaeg 6 (3–18) vs. 7 (3–24) päeva; p < 0,001) (105).
Septilises šokis patsientidele väikeses annuses kortikosteroidi manustamise kõrvaltoimena on kirjeldatud hüpernatreemia (106) ja hüperglükeemia esinemissageduse tõusu (107). Kuigi sündroomide ja tulemi seost ei ole näidatud, tuleks nende teket siiski võimaluse korral vältida. ADRENAL-i uuringus kirjeldati kokku 33 soovimatut sündmust või kõrvaltoimet. Rohkem esines neid hüdrokortisoonirühmas: 27 (1,1%). Platseeborühmas oli neid 6 (0,3%) (p = 0,009) (107).
Lisaks on kirjeldatud kortikosteroidide kataboolset toimet metabolismile, nendest tingitud aeglasemat haavade ja seedetrakti veritsust, kuid mitmekeskuselises juhuslikustatud kontrolluuringus ei leitud, et kortikosteroidirühmas oleksid need sagedasemad kui platseeborühmas (107).
Kortikosteroide ei soovitata kasutada šokita sepsisehaigete raviks. Madala kvaliteediga metaanalüüsis, kuhu kaasati 826 patsienti, leiti, et hüdrokortisooni saanud sepsisehaigete 28 päeva suremus oli 140/414 (33,8%) ning platseeborühmas 126/412 (30,6%) (RR 1,11; 95% CI 0,91–1,34) (104). Eraldi toodi esile soovitus suures annuses kortikosteroidide kasutamiseks ägeda respiratoorse distressi sündroomiga patsientide puhul (103).
Septilises šokis patsientidele väikeses annuses kortikosteroidide manustamine on suhteliselt odav ja kortikosteroidid on kättesaadavad. Ravijuhendi töörühm leidis, et kuigi suremuses vahet ei ilmnenud, oli teisese tulemusnäitaja puhul (intensiivravikestuse vähenemine) oluline vahe kortikosteroidide kasuks. Tähtis on ka see, et kortikosteroidirühmas ei esinenud märkimisväärsel hulgal kõrvaltoimeid. Seepärast otsustas töörühm anda nõrga positiivse soovituse kasutada kortikosteroide septilise šoki korral. Šokita septilise patsiendi puhul ei saa nende kasutamist soovitada.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 17 tõendusmaterjali kokkuvõtteid.
Huvi kortikosteroidide väikeses annuses kasutamise vastu tekkis taas pärast hüpotalamuse-hüpofüüsi-neerupealise telje düsfunktsiooni avastamist septilises šokis patsientidel. Düsfunktsiooni esinemissagedus on 40–60% ning see on seotud vähenenud tundlikkusega vasopressoritele ja suremuse suurenemisega (102).
ESICM-i ja SCCM-i 2017. aasta konsensusjuhistes, milles käsitletakse kortikosteroidipuudulikkuse diagnoosimist ja ravi kriitilises seisundis patsientidel, soovitatakse kasutada kortikosteroide juhul, kui septiline šokk ei ole korrigeeritav infusioonraviga ning mõõdukas või vasopressoorse ravimi suure annusega (nõrk positiivne soovitus, madal tõendatuse aste). Hüdrokortisooniannus peaks sel juhul olema alla 400 mg ööpäevas rohkem kui kolme päeva jooksul (103).
Soovitus põhineb madala kvaliteediga metaanalüüsil, millesse kaasati 1444 patsienti. Hüdrokortisooni saanud patsientide 28 päeva suremus oli 291/741 (39,3%) ning platseeborühmas 302/703 (43,0%) (RR 0,88; 95% CI 0,78–0,99) (104).
Keskmise kvaliteediga mitmekeskuselises juhuslikustatud kontrolluuringus (ADRENAL), kuhu kaasati 69 intensiivraviosakonna 3800 septilises šokis patsienti, võrreldi hüdrokortisooni toimet platseeboga. Hüdrokortisooni manustati 200 mg päevas seitsme päeva jooksul püsiinfusioonina. Tegu on seni suurima uuringuga kortikosteroidide manustamise kohta septilises šokis patsientidel. Uuringusse kaasati valikuliselt rasked haiged, kes vajasid enne uuringut kopsude kunstlikku ventilatsiooni ja üle nelja tunni vasopressoorset ravi. Leiti, et võrreldes platseeboga ei vähendanud hüdrokortisooni kasutamine 90 päeva suremust – hüdrokortisooni saanud patsientide suremus oli 511/1832 (27,9%), kontrollrühmas 526/1826 (28,8%) (OR 0,95; 95% CI 0,82–1,10). Efekt puudus ka alarühmade analüüsimisel. Samas lahenes hüdrokortisooni saanud patsientidel šokk kiiremini (mediaanaeg 3 (2–5) vs. 4 (2–9) päeva, p < 0,001) ja vähenes erütrotsüütide ülekande vajadus (37,0% vs. 41,7%, p = 0,004); lühenes intensiivraviosakonnas viibimise aeg (mediaanaeg 10 (5–30) vs. 12 (6–42) päeva, p < 0,001) ning sai varem lõpetada kopsude kunstliku ventilatsiooni esimese episoodi. Ventilaatorravipäevade arvus rühmade vahel erinevust ei leitud (mediaanaeg 6 (3–18) vs. 7 (3–24) päeva; p < 0,001) (105).
Septilises šokis patsientidele väikeses annuses kortikosteroidi manustamise kõrvaltoimena on kirjeldatud hüpernatreemia (106) ja hüperglükeemia esinemissageduse tõusu (107). Kuigi sündroomide ja tulemi seost ei ole näidatud, tuleks nende teket siiski võimaluse korral vältida. ADRENAL-i uuringus kirjeldati kokku 33 soovimatut sündmust või kõrvaltoimet. Rohkem esines neid hüdrokortisoonirühmas: 27 (1,1%). Platseeborühmas oli neid 6 (0,3%) (p = 0,009) (107).
Lisaks on kirjeldatud kortikosteroidide kataboolset toimet metabolismile, nendest tingitud aeglasemat haavade ja seedetrakti veritsust, kuid mitmekeskuselises juhuslikustatud kontrolluuringus ei leitud, et kortikosteroidirühmas oleksid need sagedasemad kui platseeborühmas (107).
Kortikosteroide ei soovitata kasutada šokita sepsisehaigete raviks. Madala kvaliteediga metaanalüüsis, kuhu kaasati 826 patsienti, leiti, et hüdrokortisooni saanud sepsisehaigete 28 päeva suremus oli 140/414 (33,8%) ning platseeborühmas 126/412 (30,6%) (RR 1,11; 95% CI 0,91–1,34) (104). Eraldi toodi esile soovitus suures annuses kortikosteroidide kasutamiseks ägeda respiratoorse distressi sündroomiga patsientide puhul (103).
Septilises šokis patsientidele väikeses annuses kortikosteroidide manustamine on suhteliselt odav ja kortikosteroidid on kättesaadavad. Ravijuhendi töörühm leidis, et kuigi suremuses vahet ei ilmnenud, oli teisese tulemusnäitaja puhul (intensiivravikestuse vähenemine) oluline vahe kortikosteroidide kasuks. Tähtis on ka see, et kortikosteroidirühmas ei esinenud märkimisväärsel hulgal kõrvaltoimeid. Seepärast otsustas töörühm anda nõrga positiivse soovituse kasutada kortikosteroide septilise šoki korral. Šokita septilise patsiendi puhul ei saa nende kasutamist soovitada.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 17 tõendusmaterjali kokkuvõtteid.
Eelkoormuse parameetrid
| 25 |
|
Sepsise, sh septilise šoki korral kaaluge vedelikutundlikkuse hindamiseks eelkoormuse dünaamiliste parameetrite mõõtmist. Nõrk positiivne soovitus, väga madal tõenduspõhisus. |
Sepsise ravis on tähtis koht ringleva vere mahu taastamisel veenisiseste lahustega, et parandada südame löögimahtu ja kudede varustatust hapnikuga. Ebavajalik või liigne infusioon võib aga põhjustada tüsistusi, näiteks perifeerseid turseid, kopsuturset ja abdominaalset kompartmentsündroomi. Liberaalse infusioonistrateegia kasutamine septilises šokis patsientide puhul võib suurendada suremust (108, 109), mistõttu on oluline vältida vedelike üleliigset manustamist.
Südame löögimaht sõltub kolmest tegurist: eelkoormusest ehk südamelihase pingest kontraktsiooni alguses, südamelihase kontraktiilsusest ja järelkoormusest. Vedelikutundlike patsientide eelkoormust on võimalik vedelikravi abil suurendada ja seeläbi löögimahtu parandada. Kui eelkoormuse suurenemine jätkub, saabub aga olukord, kus südamelihas on diastoli lõpuks maksimaalselt venitatud ja edasine infusioonravi löögimahtu enam ei paranda. Levinud praktika on rakendada empiirilist infusioonravi ning jälgida selle efekti patsiendi hemodünaamikale, kuid ka efekti puudumise korral on patsient juba vedelikukoormuse kätte saanud. Eelkoormuse hindamine staatiliste või dünaamiliste parameetrite abil võimaldaks võimaldaks hinnata infusioonravi mõju südame minutmahu suurenemisele juba enne vedeliku manustamist (110).
Eelkoormuse staatilised parameetrid on ühes ajahetkes mõõdetavad väärtused – tsentraalvenoosne rõhk (CVP), kopsuarteri kiilumisrõhk ja vasaku vatsakese lõppdiastoolne maht (111). Varem on neid parameetreid kasutatud infusioonravi vajalikkuse üle otsustamisel.
Eelkoormuse dünaamilised parameetrid aitavad hinnata ühe või teise hemodünaamika parameetri muutust lühikese aja jooksul, tingituna rindkeresisese rõhu muutustest kopsude kunstlikul ventilatsioonil või venoosse naasu suurenemisest jalgade passiivsel tõstmisel (112).
Nii eelkoormuse staatiliste kui ka dünaamiliste parameetrite hindamiseks on tarvis eriaparatuuri ja kindlat monitori, samuti on enamasti vaja kanüülida tsentraalveen ja/või perifeerne arter. Tehnoloogia kasutamine nõuab eriväljaõpet. Ka hea väljaõppe korral võib nii staatiliste kui ka dünaamiliste parameetrite mõõtmine olla ajakulukas.
Südame löögimaht sõltub kolmest tegurist: eelkoormusest ehk südamelihase pingest kontraktsiooni alguses, südamelihase kontraktiilsusest ja järelkoormusest. Vedelikutundlike patsientide eelkoormust on võimalik vedelikravi abil suurendada ja seeläbi löögimahtu parandada. Kui eelkoormuse suurenemine jätkub, saabub aga olukord, kus südamelihas on diastoli lõpuks maksimaalselt venitatud ja edasine infusioonravi löögimahtu enam ei paranda. Levinud praktika on rakendada empiirilist infusioonravi ning jälgida selle efekti patsiendi hemodünaamikale, kuid ka efekti puudumise korral on patsient juba vedelikukoormuse kätte saanud. Eelkoormuse hindamine staatiliste või dünaamiliste parameetrite abil võimaldaks võimaldaks hinnata infusioonravi mõju südame minutmahu suurenemisele juba enne vedeliku manustamist (110).
Eelkoormuse staatilised parameetrid on ühes ajahetkes mõõdetavad väärtused – tsentraalvenoosne rõhk (CVP), kopsuarteri kiilumisrõhk ja vasaku vatsakese lõppdiastoolne maht (111). Varem on neid parameetreid kasutatud infusioonravi vajalikkuse üle otsustamisel.
Eelkoormuse dünaamilised parameetrid aitavad hinnata ühe või teise hemodünaamika parameetri muutust lühikese aja jooksul, tingituna rindkeresisese rõhu muutustest kopsude kunstlikul ventilatsioonil või venoosse naasu suurenemisest jalgade passiivsel tõstmisel (112).
Nii eelkoormuse staatiliste kui ka dünaamiliste parameetrite hindamiseks on tarvis eriaparatuuri ja kindlat monitori, samuti on enamasti vaja kanüülida tsentraalveen ja/või perifeerne arter. Tehnoloogia kasutamine nõuab eriväljaõpet. Ka hea väljaõppe korral võib nii staatiliste kui ka dünaamiliste parameetrite mõõtmine olla ajakulukas.
Tuleb arvestada, et teatud seisundite puhul (hemorraagiline šokk, sepsis) võib infusioonravi päästa elu. Seepärast ei tohiks ravi viibida hemodünaamika monitori paigaldamise tõttu. Südame eelkoormust tuleks mõõta vaid šokis patsientidel. Infusiooni tegemisel peab lähtuma kliinilisest kontekstist – näiteks tuleb ka vedelikutundlikul ARDS-haigel infusioonravi maksimaalselt piirata (113).
Eelkoormuse dünaamiliste parameetrite mõõtmisel on mitu olulist piirangut: hingamistsüklist tingitud parema poole eelkoormuse varieeruvuse mõõtmine eeldab, et spontaanne hingamisaktiivsus puudub, ning pulsskontuuranalüüsi kasutamine regulaarset südametööd. Pulsirõhu ja vasaku vatsakese löögimahu variatsioon näitavad vasaku vatsakese eelkoormust. Meetodid võivad olla ebatäpsed parema vatsakese puudulikkuse korral. Pulsirõhu variatsioon on ebatäpne suure hingamissageduse korral. Lisaks eeldab dünaamiliste parameetrite kasutuselevõtt suurt baaskulu.
Väga madala kvaliteediga metaanalüüsis, kuhu kaasati 356 patsienti, ilmnes, et CVP mõõtmine on vedelikutundlikkuse hindamisel ebatäpne meetod: selle tundlikkus oli 0,62 (95% CI 0,54–0,69) ja spetsiifilisus 0,76 (95% CI 0,60–0,87) (110). CVP ebatäpsust on ka varem kirjeldatud (114, 115).
Dünaamilised parameetrid on võrreldes CVP-ga vedelikutundlikkuse hindamiseks täpsemad. Jalgade tõstmise järel südame löögimahu muutuse mõõtmine on dünaamilistest parameetritest kõige täpsem.
Väga madala kvaliteediga metaanalüüsi, kuhu kaasati 294 patsienti, leiti, et juhitaval hingamisel olevatel patsientidel on jalgade tõstmise järel südame löögimahu muutuse mõõtmise tundlikkus 0,92 (95% CI 0,82–0,97) ja spetsiifilisus 0,92 (95% CI 0,86–0,96) (110).
Jalgade tõstmise testi saab teha ka arütmiaga ja spontaanselt hingavale patsiendile. Väga madala kvaliteediga 181 patsiendiga metaanalüüsis leiti, et spontaanselt hingavatel patsientidel on testi tundlikkus 0,88 (95% CI 0,80–0,94) ja spetsiifilisus 0,88 (95% CI 0,80–0,94) (110).
Jalgade tõstmise test võib siiski olla ebatäpne, kui see ei too õõnesveeni piisavalt ringleva vere mahtu, näiteks kompressioonsukkade kasutamisel või intraabdominaalse hüpertensiooni korral.
Juhitava hingamise puhul saab dünaamilistest parameetritest kasutada südame löögimahu variatsiooni. Väga madala kvaliteediga metaanalüüsis, millesse kaasati 343 juhitaval hingamisel olevat patsienti, oli selle meetodi tundlikkus 0,79 (95% CI 0,67– 0,87) ja spetsiifilisus 0,84 (95% CI 0,74–0,90) (110).
Eelkoormuse dünaamiliste parameetrite mõõtmisel on mitu olulist piirangut: hingamistsüklist tingitud parema poole eelkoormuse varieeruvuse mõõtmine eeldab, et spontaanne hingamisaktiivsus puudub, ning pulsskontuuranalüüsi kasutamine regulaarset südametööd. Pulsirõhu ja vasaku vatsakese löögimahu variatsioon näitavad vasaku vatsakese eelkoormust. Meetodid võivad olla ebatäpsed parema vatsakese puudulikkuse korral. Pulsirõhu variatsioon on ebatäpne suure hingamissageduse korral. Lisaks eeldab dünaamiliste parameetrite kasutuselevõtt suurt baaskulu.
Väga madala kvaliteediga metaanalüüsis, kuhu kaasati 356 patsienti, ilmnes, et CVP mõõtmine on vedelikutundlikkuse hindamisel ebatäpne meetod: selle tundlikkus oli 0,62 (95% CI 0,54–0,69) ja spetsiifilisus 0,76 (95% CI 0,60–0,87) (110). CVP ebatäpsust on ka varem kirjeldatud (114, 115).
Dünaamilised parameetrid on võrreldes CVP-ga vedelikutundlikkuse hindamiseks täpsemad. Jalgade tõstmise järel südame löögimahu muutuse mõõtmine on dünaamilistest parameetritest kõige täpsem.
Väga madala kvaliteediga metaanalüüsi, kuhu kaasati 294 patsienti, leiti, et juhitaval hingamisel olevatel patsientidel on jalgade tõstmise järel südame löögimahu muutuse mõõtmise tundlikkus 0,92 (95% CI 0,82–0,97) ja spetsiifilisus 0,92 (95% CI 0,86–0,96) (110).
Jalgade tõstmise testi saab teha ka arütmiaga ja spontaanselt hingavale patsiendile. Väga madala kvaliteediga 181 patsiendiga metaanalüüsis leiti, et spontaanselt hingavatel patsientidel on testi tundlikkus 0,88 (95% CI 0,80–0,94) ja spetsiifilisus 0,88 (95% CI 0,80–0,94) (110).
Jalgade tõstmise test võib siiski olla ebatäpne, kui see ei too õõnesveeni piisavalt ringleva vere mahtu, näiteks kompressioonsukkade kasutamisel või intraabdominaalse hüpertensiooni korral.
Juhitava hingamise puhul saab dünaamilistest parameetritest kasutada südame löögimahu variatsiooni. Väga madala kvaliteediga metaanalüüsis, millesse kaasati 343 juhitaval hingamisel olevat patsienti, oli selle meetodi tundlikkus 0,79 (95% CI 0,67– 0,87) ja spetsiifilisus 0,84 (95% CI 0,74–0,90) (110).
Dünaamiline parameeter on ka pulsirõhu variatsioon. Väga madala kvaliteediga metaanalüüsis 768 juhitaval hingamisel oleva patsiendiga oli selle tundlikkus 0,84 (95% CI 0,75–0,90) ja spetsiifilisus 0,84 (95% CI 0,77–0,90) (110).
Teistest dünaamilistest parameetritest pisut ebatäpsem on alumise õõnesveeni diameetri variatsioon. Väga madala kvaliteediga metaanalüüsides leiti selle puhul 294 juhitaval hingamisel oleva patsiendi seas tundlikkus 0,77 (95% CI 0,44–0,94) ja spetsiifilisus 0,85 (95% CI 0,49–0,97) ning 181 spontaanhingamisel patsiendil tundlikkus 0,31–0,70 ja spetsiifilisus 0,80–0,97 (110).
Ravijuhendi töörühm leidis, et kuna sekkumist on uuritud vaid väikese valimiga jälgimisuuringutes, ei ole võimalik teha kindlat üldistavat järeldust. Uuringutel on ka ühiseid puuduseid – uuritud on kõiki intensiivravihaigeid, mitte ainult septilise šoki diagnoosiga patsiente. Enamasti alustati infusioonravi juba enne patsientide uuringusse kaasamist, seega ei pruugi kirjeldatud efekt olla täpne.
Olemasoleva tõendusmaterjali põhjal võib aga järeldada, et vedelikravi tundlikkuse hindamiseks on dünaamilised eelkoormuse parameetrid täpsemad kui staatilised parameetrid. Samas eeldaks dünaamiliste parameetrite kasutuselevõtt suurt baaskulu monitori ja/või ehhokardiograafia aparatuuri hankimiseks. Ka korduva ehhokardiograafia või monitooringuseadmete ühekordsete tarvikute kulu võib (olenevalt monitooringust) olla suur.
Arvestades vähest tõenduspõhisust ja seda, et teenus on praegu Eesti haiglates ebaühtlaselt kättesaadav (aparatuuri olemasolu ja oskuste poolest), ei saa anda tugevat soovitust eelkoormuse dünaamiliste parameetrite rutiinseks jälgimiseks.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 11 tõendusmaterjali kokkuvõtteid.
Teistest dünaamilistest parameetritest pisut ebatäpsem on alumise õõnesveeni diameetri variatsioon. Väga madala kvaliteediga metaanalüüsides leiti selle puhul 294 juhitaval hingamisel oleva patsiendi seas tundlikkus 0,77 (95% CI 0,44–0,94) ja spetsiifilisus 0,85 (95% CI 0,49–0,97) ning 181 spontaanhingamisel patsiendil tundlikkus 0,31–0,70 ja spetsiifilisus 0,80–0,97 (110).
Ravijuhendi töörühm leidis, et kuna sekkumist on uuritud vaid väikese valimiga jälgimisuuringutes, ei ole võimalik teha kindlat üldistavat järeldust. Uuringutel on ka ühiseid puuduseid – uuritud on kõiki intensiivravihaigeid, mitte ainult septilise šoki diagnoosiga patsiente. Enamasti alustati infusioonravi juba enne patsientide uuringusse kaasamist, seega ei pruugi kirjeldatud efekt olla täpne.
Olemasoleva tõendusmaterjali põhjal võib aga järeldada, et vedelikravi tundlikkuse hindamiseks on dünaamilised eelkoormuse parameetrid täpsemad kui staatilised parameetrid. Samas eeldaks dünaamiliste parameetrite kasutuselevõtt suurt baaskulu monitori ja/või ehhokardiograafia aparatuuri hankimiseks. Ka korduva ehhokardiograafia või monitooringuseadmete ühekordsete tarvikute kulu võib (olenevalt monitooringust) olla suur.
Arvestades vähest tõenduspõhisust ja seda, et teenus on praegu Eesti haiglates ebaühtlaselt kättesaadav (aparatuuri olemasolu ja oskuste poolest), ei saa anda tugevat soovitust eelkoormuse dünaamiliste parameetrite rutiinseks jälgimiseks.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 11 tõendusmaterjali kokkuvõtteid.
Edasine ravi
| 26 |
|
Sepsise, sh septilise šokiga patsiendi haiglaravikoha otsustamisel lähtuge tema kliinilisest seisundist ja konkreetse haigla ravikorraldusest. Praktiline soovitus |
Infektsioonravis on võtete õigeaegsus ning diagnostika täpsus ja kiirus määrava tähtsusega. Õigete ravivõtete rakendamine on seotud raviarsti oskuste ja teadmistega ning võib erialati varieeruda. On uuringuid, milles kirjeldatakse eri skooringusüsteemide (kokku u 100) või sümptomikomplektide kasutatavust infektsiooniga ja suure riskiga patsientide äratundmiseks. Veel ei ole aga selge, kas patsiendi raviosakonna üle otsustamisel võiks kasutada mõnda konkreetset skooringusüsteemi.
Ravijuhendi koostamisel ei leitud uuringuid, milles vaadeldaks konkreetse skooringusüsteemi kasutamist patsiendi raviosakonna määramiseks ja selle mõju suremusele või haiglaravi kestusele.
Väga madala kvaliteediga korduvas läbilõikeuuringus 1140 patsiendil, mille eesmärk oli sepsise varajase avastamise süsteemi väljatöötamine, ei leitud, et süsteemi rakendamine oleks toonud olulist kasu suremuse ja intensiivravi või haiglaravi kestuse vähendamisel. Uuringu käigus töötati raskete haigete selekteerimise eesmärgil SIRS-i kriteeriumite ja organi düsfunktsiooni tunnuste (süstoolne vererõhk alla 100 mm Hg; laktaadisisaldus üle 2,2 mmol/L) alusel välja skooringusüsteem, mis alarmeeris arvutisüsteemi kaudu sepsise meeskonda (intern, koordinaatorid, õde), kes hakkasid seejärel patsiendiga tegelema. (116).
Madala kvaliteediga kohortuuringu käigus uuriti sepsise käsitluse laiendatud komplekti mõju ravitulemustele 273 sepsise või septilise šokiga patsiendi seas, kes viibisid kirurgilises intensiivraviosakonnas. Sepsise käsitluse komplekt hõlmab sepsise diagnoosimise järel kuue tunni jooksul tehtavaid analüüse või protseduure (laktaadisisalduse mõõtmine, verekülvide tegemine, infusioonravi jmt). Patsiendid jagati kahte rühma: 1) sepsise käsitluse komplekt (n = 186) ja 2) sepsise käsitluse laiendatud komplekt (n = 68). Laiendatud käsitluse komplekt hõlmas lisaks tegevusele ka intensiivraviarsti kohalolekut. Kontrollrühmas (n = 19) oli samade parameetritega retrospektiivsed haiged. Kolme rühma ravitulemuste analüüsist selgus, et suremus oli kontrollrühmas 42%, sepsise käsitluse komplekti rühmas 28% ning sepsise käsitluse laiendatud komplekti rühmas 20% (p < 0,01). Haiglaravi kestus vähenes samuti: vastavalt 38, 29 ja 22 päeva (p = 0,01). Uuringu tulemustes kirjeldati ka haigusjuhu maksumuse vähenemist, mis oli statistiliselt mitteoluline (117).
Ravijuhendi töörühm leidis, et selle tõendusmaterjali põhjal ei saa anda soovitust kasutada patsiendi ravikoha määramiseks skooringusüsteemi. Siiski tõdeti, et skooringusüsteemid võivad aidata sepsist või septilist šokki ära tunda. Leiti ka, et iga raviasutus peaks ise otsustama vajaduse üle ühe või teise skooringusüsteemi kasutuselevõtuks.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 19 tõendusmaterjali kokkuvõtteid.
Väga madala kvaliteediga korduvas läbilõikeuuringus 1140 patsiendil, mille eesmärk oli sepsise varajase avastamise süsteemi väljatöötamine, ei leitud, et süsteemi rakendamine oleks toonud olulist kasu suremuse ja intensiivravi või haiglaravi kestuse vähendamisel. Uuringu käigus töötati raskete haigete selekteerimise eesmärgil SIRS-i kriteeriumite ja organi düsfunktsiooni tunnuste (süstoolne vererõhk alla 100 mm Hg; laktaadisisaldus üle 2,2 mmol/L) alusel välja skooringusüsteem, mis alarmeeris arvutisüsteemi kaudu sepsise meeskonda (intern, koordinaatorid, õde), kes hakkasid seejärel patsiendiga tegelema. (116).
Madala kvaliteediga kohortuuringu käigus uuriti sepsise käsitluse laiendatud komplekti mõju ravitulemustele 273 sepsise või septilise šokiga patsiendi seas, kes viibisid kirurgilises intensiivraviosakonnas. Sepsise käsitluse komplekt hõlmab sepsise diagnoosimise järel kuue tunni jooksul tehtavaid analüüse või protseduure (laktaadisisalduse mõõtmine, verekülvide tegemine, infusioonravi jmt). Patsiendid jagati kahte rühma: 1) sepsise käsitluse komplekt (n = 186) ja 2) sepsise käsitluse laiendatud komplekt (n = 68). Laiendatud käsitluse komplekt hõlmas lisaks tegevusele ka intensiivraviarsti kohalolekut. Kontrollrühmas (n = 19) oli samade parameetritega retrospektiivsed haiged. Kolme rühma ravitulemuste analüüsist selgus, et suremus oli kontrollrühmas 42%, sepsise käsitluse komplekti rühmas 28% ning sepsise käsitluse laiendatud komplekti rühmas 20% (p < 0,01). Haiglaravi kestus vähenes samuti: vastavalt 38, 29 ja 22 päeva (p = 0,01). Uuringu tulemustes kirjeldati ka haigusjuhu maksumuse vähenemist, mis oli statistiliselt mitteoluline (117).
Ravijuhendi töörühm leidis, et selle tõendusmaterjali põhjal ei saa anda soovitust kasutada patsiendi ravikoha määramiseks skooringusüsteemi. Siiski tõdeti, et skooringusüsteemid võivad aidata sepsist või septilist šokki ära tunda. Leiti ka, et iga raviasutus peaks ise otsustama vajaduse üle ühe või teise skooringusüsteemi kasutuselevõtuks.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 19 tõendusmaterjali kokkuvõtteid.
| 27 |
|
Kaaluge intensiivravivajadust, kui patsiendi plasma laktaadi- sisalduse absoluutväärtus on üle 4 mmol/L või pole vähenema hakanud (20% võrra ühe tunni jooksul pärast ravi alustamist). Nõrk positiivne soovitus, madal tõenduspõhisus. |
Sepsisega ja septilises šokis patsientide õige ravikoha otsustamine on tähtis, et saavutada parim ravitulemus optimaalse ressursikasutusega. Plasma laktaadisisalduse suurenemine on elundite funktsioonihäire ja halva prognoosi näitaja. Laktaadiväärtuse ja selle dünaamika hindamine on oluline, et leida suure riskiga patsiendid, kes vajavad hospitaliseerimist II või III astme intensiivravipalatisse või -osakonda.
Madala kvaliteediga süstemaatilises ülevaates vaadeldi 3 juhuslikustatud kontrolluuringut ja 12 jälgimisuuringut, kuhu oli kaasatud 2647 kriitilises seisundis, sealhulgas sepsisega patsienti. Uuringu eesmärk oli hinnata plasma laktaadisisalduse dünaamika seost suremusega. Laktaadisisalduse muutust hinnati uuringutes eri ajavahemikul (6–24 tundi) ja see varieerus 10–50%. Ülevaate autorid järeldasid, et laktaadisisalduse vähenemine ennustab kriitilises seisus patsientidel väiksemat suremust (RR 0,41; 95% CI 0,28–0,60) ja selle diagnostiline väärtus on kliiniliseks kasutamiseks optimaalne (118).
Ravijuhendi töörühm leidis, et sepsise patsiendil plasma laktaadisisalduse määramine on tähtis. Tavad on Eesti haiglates praegu erinevad. Sepsise puhul on oluline varajane maksimaalne ravi, sest septilise šoki väljakujunemisel on prognoos juba tunduvalt halvem. Töörühm soovitab intensiivraviarsti konsultatsiooni, kui plasma laktaadiväärtus on > 4 mmol/L või puudub langustrend 20% võrra ühe tunni jooksul ravi algusest. See aitab leida suure riskiga patsiendid, kes vajavad II või III astme intensiivravi. Osakonna valik oleneb kliinilisest kontekstist ning konkreetse raviasutuse võimalustest ja töökorraldusest. Sarnane, eksperdiarvamusel põhinev soovitus on antud ka NICE-i ravijuhendis (9).
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 20 tõendusmaterjali kokkuvõtteid.
Madala kvaliteediga süstemaatilises ülevaates vaadeldi 3 juhuslikustatud kontrolluuringut ja 12 jälgimisuuringut, kuhu oli kaasatud 2647 kriitilises seisundis, sealhulgas sepsisega patsienti. Uuringu eesmärk oli hinnata plasma laktaadisisalduse dünaamika seost suremusega. Laktaadisisalduse muutust hinnati uuringutes eri ajavahemikul (6–24 tundi) ja see varieerus 10–50%. Ülevaate autorid järeldasid, et laktaadisisalduse vähenemine ennustab kriitilises seisus patsientidel väiksemat suremust (RR 0,41; 95% CI 0,28–0,60) ja selle diagnostiline väärtus on kliiniliseks kasutamiseks optimaalne (118).
Ravijuhendi töörühm leidis, et sepsise patsiendil plasma laktaadisisalduse määramine on tähtis. Tavad on Eesti haiglates praegu erinevad. Sepsise puhul on oluline varajane maksimaalne ravi, sest septilise šoki väljakujunemisel on prognoos juba tunduvalt halvem. Töörühm soovitab intensiivraviarsti konsultatsiooni, kui plasma laktaadiväärtus on > 4 mmol/L või puudub langustrend 20% võrra ühe tunni jooksul ravi algusest. See aitab leida suure riskiga patsiendid, kes vajavad II või III astme intensiivravi. Osakonna valik oleneb kliinilisest kontekstist ning konkreetse raviasutuse võimalustest ja töökorraldusest. Sarnane, eksperdiarvamusel põhinev soovitus on antud ka NICE-i ravijuhendis (9).
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 20 tõendusmaterjali kokkuvõtteid.
| 28 |
|
Sepsise, sh septilise šokiga patsiendil, kes põeb rasket kroonilist haigust, kaaluge parima toetava ravi rakendamist. [AJAKOHASTATUD 2024] Nõrk positiivne soovitus, väga madal tõenduspõhisus. |
Sepsise ja septilise šokiga patsientide suremus on kirjanduse andmetel kuni 40% (3). Suremust suurendavad märkimisväärselt kaasuvad rasked kroonilised haigused ja kõrge vanus. Uuringutes on leitud, et mitut kroonilist haigust põdeva sepsisehaige ellujäämise korral on tema elukvaliteet sageli küllaltki halb. Seepärast on oluline hinnata ravi mahtu ja sisu sepsise ning septilise šokiga patsientidel, kes tõenäoliselt ei jää ellu või kelle elukvaliteet on pärast intensiivravi väga kehv. Lähedaste kaasamist otsustusprotsessi peaks kaaluma iga juhtumi puhul eraldi.
Mõõduka kvaliteediga juhuslikustatud uuringus, kuhu kaasati 309 üle 80-aastast patsienti sisehaiguste-, kardioloogia- või pulmonoloogiaosakonnast, võrreldi aktiivse suhtluse mõju patsientide ja nende omaste rahulolule. Näidati, et spetsialisti kaasamine elulõpuküsimuste aruteludesse näiteks raviplaanist, võimalikest tulemustest ja edasise ravi soovidest vähendas oluliselt posttraumaatilise stressi, depressiooni ning ärevuse esinemist võrreldes sellega, kui patsientide ja omastega suhtles tavaline meditsiinipersonal (119).
Madala kvaliteediga küsimustikul põhinevas uuringus, kuhu kaasati 688 tervishoiutöötajat (arstid ja õed), leidis 80% vastanutest, et tulemusteta ravil on negatiivne mõju nii patsientidele, sugulastele kui ka tervishoiutöötajatele. Samuti on see tervishoiusüsteemile suur kuluallikas (120).
Madala kvaliteediga süstemaatilise kirjanduse ülevaatesse kaasati 14 uuringut: 3 juhuslikustatud uuringut, 4 mittejuhuslikustatud sekkumisuuringut ning 7 kirjeldavat uuringut. Näidati, et patsiendi lähedased olid rohkem rahul, kui 1) neid kaasati otsustamisprotsessi; 2) nad said vestlustel rohkem rääkida; 3) kasutati empaatilisi väljendeid ning 4) patsientide sümptomid oli hästi kontrolli all (121).
Ameerika Ühendriikide paljude organisatsioonide konsensusdokumendis on määratletud, et kohased intensiivravieesmärgid on need, mille tulemusena jääb patsient mõistliku tõenäosusega ellu ka väljaspool intensiivraviosakonda sellise kognitiivse võimekusega, et on võimeline tajuma ravi kasulikkust. 90–95% arstidest ei soovinud rakendada juhitavat hingamist või elustamist, kui patsient on olnud vegetatiivses seisundis, dementne või tal on raske neuroloogiline kahjustus. 87% arstidest ei soovinud juhitavat hingamist situatsioonides, kus patsient väljaspool intensiivraviosakonda ellu ei jääks (122).
Ravijuhendi töörühm leidis, et halva elukvaliteedi nimel pikaaegse ja kalli intensiivravi rakendamine ei ole ühelegi poolele emotsionaalselt ega rahaliselt otstarbekas. Raskete krooniliste haigustega sepsises või septilises šokis patsiendi ravimahu ja -sisu otsustamine on oluline küsimus. Otsustusprotsessi tuleb parimal võimalikul viisil kaasata patsient ja tema lähedased. Töörühm otsustas sõnastada sellekohase soovituse varasemast selgemaks ja üheselt arusaadavaks ning ühtlustada termineid Eesti palliatiivravi juhendi (123) põhjal, mispärast lisati soovitusele ajakohastamise märkus.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 18 tõendusmaterjali kokkuvõtteid.
Mõõduka kvaliteediga juhuslikustatud uuringus, kuhu kaasati 309 üle 80-aastast patsienti sisehaiguste-, kardioloogia- või pulmonoloogiaosakonnast, võrreldi aktiivse suhtluse mõju patsientide ja nende omaste rahulolule. Näidati, et spetsialisti kaasamine elulõpuküsimuste aruteludesse näiteks raviplaanist, võimalikest tulemustest ja edasise ravi soovidest vähendas oluliselt posttraumaatilise stressi, depressiooni ning ärevuse esinemist võrreldes sellega, kui patsientide ja omastega suhtles tavaline meditsiinipersonal (119).
Madala kvaliteediga küsimustikul põhinevas uuringus, kuhu kaasati 688 tervishoiutöötajat (arstid ja õed), leidis 80% vastanutest, et tulemusteta ravil on negatiivne mõju nii patsientidele, sugulastele kui ka tervishoiutöötajatele. Samuti on see tervishoiusüsteemile suur kuluallikas (120).
Madala kvaliteediga süstemaatilise kirjanduse ülevaatesse kaasati 14 uuringut: 3 juhuslikustatud uuringut, 4 mittejuhuslikustatud sekkumisuuringut ning 7 kirjeldavat uuringut. Näidati, et patsiendi lähedased olid rohkem rahul, kui 1) neid kaasati otsustamisprotsessi; 2) nad said vestlustel rohkem rääkida; 3) kasutati empaatilisi väljendeid ning 4) patsientide sümptomid oli hästi kontrolli all (121).
Ameerika Ühendriikide paljude organisatsioonide konsensusdokumendis on määratletud, et kohased intensiivravieesmärgid on need, mille tulemusena jääb patsient mõistliku tõenäosusega ellu ka väljaspool intensiivraviosakonda sellise kognitiivse võimekusega, et on võimeline tajuma ravi kasulikkust. 90–95% arstidest ei soovinud rakendada juhitavat hingamist või elustamist, kui patsient on olnud vegetatiivses seisundis, dementne või tal on raske neuroloogiline kahjustus. 87% arstidest ei soovinud juhitavat hingamist situatsioonides, kus patsient väljaspool intensiivraviosakonda ellu ei jääks (122).
Ravijuhendi töörühm leidis, et halva elukvaliteedi nimel pikaaegse ja kalli intensiivravi rakendamine ei ole ühelegi poolele emotsionaalselt ega rahaliselt otstarbekas. Raskete krooniliste haigustega sepsises või septilises šokis patsiendi ravimahu ja -sisu otsustamine on oluline küsimus. Otsustusprotsessi tuleb parimal võimalikul viisil kaasata patsient ja tema lähedased. Töörühm otsustas sõnastada sellekohase soovituse varasemast selgemaks ja üheselt arusaadavaks ning ühtlustada termineid Eesti palliatiivravi juhendi (123) põhjal, mispärast lisati soovitusele ajakohastamise märkus.
Vaata veebilehelt www.ravijuhend.ee 2018. aastal koostatud algse ravijuhendi kliinilise küsimuse 18 tõendusmaterjali kokkuvõtteid.
Lisad
Lisa 1. Sepsise äratundmine ja esmane käsitlus
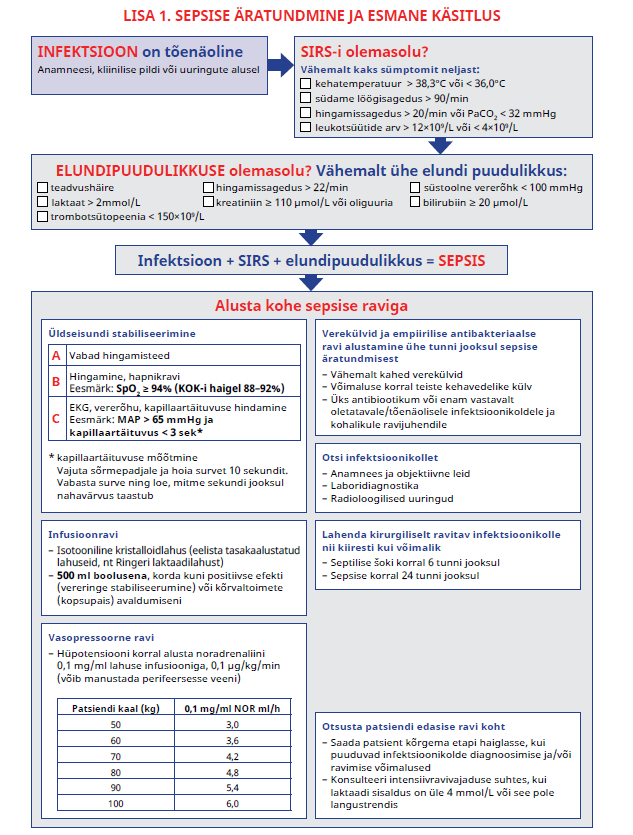
Lisa 2. National early warning score (NEWS) 2
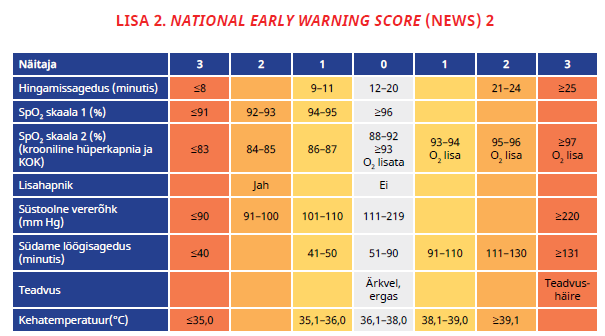 Kasuta skoori arvutamisel ainult üht SpO2 skaalat!
Kasuta skoori arvutamisel ainult üht SpO2 skaalat!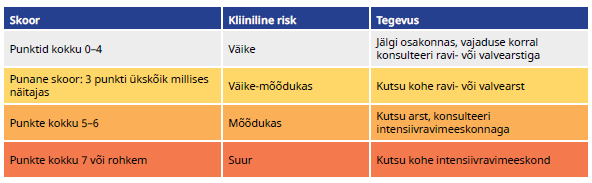 Allikas:
Allikas:Royal College of Physicians. National Early Warning Score (NEWS) 2: Standardising the assessment of acuteillness severity in the NHS. Updated report of a working party. London: RCP, 2017.
NB! Eestikeelset tõlget ei ole Royal College of Physicians heaks kiitnud.
Kasutatud kirjandus
- Estonian handbook for guidelines development 2020. Estonian Health Insurance Fund; 2021. https://ravijuhend.ee/uploads/userfiles/Estonian_ Handbook_for_Guidelines_Development_2020.pdf.
- WHO top 10 causes of death. WHO (2015).
- Rhodes A et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med 43, 304–377 (2017).
- Kliiniline audit. Sepsise ravi kvaliteet. Eesti Haigekassa; 2015. www. haigekassa.ee/sites/default/files/indikaatorid/sepsis_ravi_kvaliteet_summary_ js_3.pdf.
- Levy MM, Rhodes A, Phillips GS, Townsend SR, Schorr CA, Beale R, Osborn T, Lemeshow S, Chiche JD, Artigas A, Dellinger RP. Surviving Sepsis Campaign: association between performance metrics and outcomes in a 7.5-year study. Crit Care Med 2015 Jan;43(1):3–12.
- Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med 47, 1181–1247 (2021).
- Dellinger RP et al. Surviving Sepsis Campaign. Crit Care Med 41, 580–637 (2013).
- Singer M et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315, 801–10 (2016).
- Sepsis: recognition, diagnosis and early management. Guidance and guidelines. NICE (2016).
- Bone RC et al. Definitions for Sepsis and Organ Failure and Guidelines for the Use of Innovative Therapies in Sepsis. Chest 101, 1644–1655 (1992).
- Levy MM et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med 31, 1250–6 (2003).
- Seymour CW et al. Assessment of Clinical Criteria for Sepsis. JAMA 315, 762 (2016).
- Makam AN et al. Clinical Criteria to Identify Patients With Sepsis. JAMA 316, 453 (2016).
- Gerdin M et al. Clinical Criteria to Identify Patients With Sepsis. JAMA 316, 453 (2016).
- Sartelli M et al. Raising concerns about the Sepsis-3 definitions. World J Emerg Surg 13, 6 (2018).
- Antonelli M et al. Quick SOFA Clarification for the Practitioner.
- Song J-U et al. Performance of the quick Sequential (sepsis-related) Organ Failure Assessment score as a prognostic tool in infected patients outside the intensive care unit: a systematic review and meta-analysis. Crit Care 22, 28 (2018).
- Dorsett M et al. qSOFA Has Poor Sensitivity for Prehospital Identification of Severe Sepsis and Septic Shock. Prehosp Emerg Care 21, 489–497 (2017).
- Royal College of Physicians. National Early Warning Score (NEWS) 2: Standardising the assessment of acute-illness severity in the NHS. Updated report of a working party. London: RCP, 2017.
- Rivers EP et al. Early Goal-Directed Therapy in the Treatment of Severe Sepsis and Septic Shock. N Engl J Med 345, 1368–1377 (2001).
- ProCESS Investigators et al. A Randomized Trial of Protocol-Based Care for Early Septic Shock. N Engl J Med 370, 1683–1693 (2014).
- Bailey M et al. Goal-Directed Resuscitation for Patients with Early Septic Shock. N Engl J Med 371, 1496–1506 (2014).
- Mouncey PR et al. Trial of Early, Goal-Directed Resuscitation for Septic Shock. N Engl J Med 372, 1301–1311 (2015).
- PRISM investigators et al. Early, Goal-Directed Therapy for Septic Shock — A Patient-Level Meta-Analysis. N Engl J Med 376, 2223–2234 (2017).
- Intravenous fluid therapy in adults in hospital. Guidance and Guidelines. NICE (2013).
- Intravenous fluid therapy in adults in hospital. Guidance and Guidelines. NICE guideline CG174 Appendix A: Summary of new evidence from surveillance. 1–35 (2017).
- See KC et al. Shock in the First 24 h of Intensive Care Unit Stay. Shock 43, 456–462 (2015).
- Lee SJ et al. Increased fluid administration in the first three hours of sepsis resuscitation is associated with reduced mortality: A retrospective cohort study. Chest 146, 908–915 (2014).
- Leisman D et al. Association of Fluid Resuscitation Initiation Within 30 Minutes of Severe Sepsis and Septic Shock Recognition With Reduced Mortality and Length of Stay. Ann Emerg Med 68, 298–311 (2016).
- McIntyre LA et al. Resuscitating patients with early severe sepsis: a Canadian multicentre observational study. Can J Anaesth 54, 790–798 (2007).
- Angus DC et al. A systematic review and meta-analysis of early goal-directed therapy for septic shock: the ARISE, ProCESS and ProMISe Investigators. Intensive Care Med 41, 1549–1560 (2015).
- Rochwerg B et al. Fluid resuscitation in sepsis: A systematic review and network meta-analysis. Ann Intern Med 161, 347–355 (2014).
- Rochwerg B et al. Fluid type and the use of renal replacement therapy in sepsis: a systematic review and network meta-analysis. Intensive Care Med 41, 1561–1571 (2015).
- Yunos NM et al. The biochemical effects of restricting chloride-rich fluids in intensive care. Crit Care Med 39, 2419–2424 (2011).
- Beran A, Altorok N, Srour O, Malhas SE, Khokher W, Mhanna M, Ayesh H, Aladamat N, Abuhelwa Z, Srour K, Mahmood A, Altorok N, Taleb M, Assaly R. Balanced Crystalloids versus Normal Saline in Adults with Sepsis: A Comprehensive Systematic Review and Meta-Analysis. J Clin Med 2022 Apr 1;11(7):1971.
- Xue M, Zhang X, Liu F, Chang W, Xie J, Xu J, Yang Y, Qiu H. Effects of chloride content of intravenous crystalloid solutions in critically ill adult patients: a meta-analysis with trial sequential analysis of randomized trials. Ann Intensive Care. 2019 Feb 13;9(1):30.
- Bentzer P et al. Effect of dextran-70 on outcome in severe sepsis; A propensity- score matching study. Scand J Trauma Resusc Emerg Med 25, 1–9 (2017).
- Moeller C et al. How safe is gelatin? A systematic review and meta-analysis of gelatin-containing plasma expanders vs crystalloids and albumin. J Crit Care 35, 75–83 (2016).
- Bagshaw S et al. the Influence of Knowledge Management on. Curr Opin Crit Care 13, 541–548 (2007).
- Payen D et al. A positive fluid balance is associated with a worse outcome in patients with acute renal failure. Crit Care 12, 1–7 (2008).
- Bellomo R et al. An observational study fluid balance and patient outcomes in the randomized evaluation of normal vs. augmented level of replacement therapy trial*. Crit Care Med 40, 1753–1760 (2012).
- Sakr Y et al. Higher Fluid Balance Increases the Risk of Death from Sepsis: Results from a Large International Audit*. Crit Care Med 45, 386–394 (2017).
- Caironi P et al. Albumin Replacement in Patients with Severe Sepsis or Septic Shock. N Engl J Med 370, 1412–1421 (2014).
- Kumar A et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock*. Crit Care Med 34, 1589–1596 (2006).
- Ferrer R et al. Empiric Antibiotic Treatment Reduces Mortality in Severe Sepsis and Septic Shock From the First Hour. Crit Care Med 42, 1749–1755 (2014).
- Bloos F et al. Effect of a multifaceted educational intervention for anti- infectious measures on sepsis mortality: a cluster randomized trial. Intensive Care Med 43, 1602–1612 (2017).
- Scheer CS et al. Quality Improvement Initiative for Severe Sepsis and Septic Shock Reduces 90-Day Mortality. Crit Care Med 45, 241–252 (2017).
- Huang J, Yang JT, Liu JC. The association between mortality and door-to- antibiotic time: a systematic review and meta-analysis. Postgrad Med J 2023 Aug 22;99(1175):1000-1007.
- Rüddel H, Thomas-Rüddel DO, Reinhart K, Bach F, Gerlach H, Lindner M, Marshall JC, Simon P, Weiss M, Bloos F, Schwarzkopf D; MEDUSA study group. Adverse effects of delayed antimicrobial treatment and surgical source control in adults with sepsis: results of a planned secondary analysis of a cluster-randomized controlled trial. Crit Care 2022 Feb 28;26(1):51.
- Ascuntar J, Mendoza D, Jaimes F. Antimicrobials administration time in patients with suspected sepsis: is faster better? An analysis by propensity score. J Intensive Care 2020 Apr 22;8:28.
- Seok H, Song J, Jeon JH, Choi HK, Choi WS, Moon S, Park DW. Timing of antibiotics in septic patients: a prospective cohort study. Clin Microbiol Infect 2020 Nov;26(11):1495-1500.
- Husabø G, Nilsen RM, Flaatten H, Solligård E, Frich JC, Bondevik GT, Braut GS, Walshe K, Harthug S, Hovlid E. Early diagnosis of sepsis in emergency departments, time to treatment, and association with mortality: An observational study. PLoS One 2020 Jan 22;15(1):e0227652.
- Lamy B et al. How to Optimize the Use of Blood Cultures for the Diagnosis of Bloodstream Infections? A State-of-the Art. Front Microbiol 7, 697 (2016).
- Azoulay E et al. Outcomes of Critically Ill Patients With Hematologic Malignancies: Prospective Multicenter Data From France and Belgium—A Groupe de Recherche Respiratoire en Réanimation Onco-Hématologique Study. J Clin Oncol 31, 2810–2818 (2013).
- Royo-Cebrecos C et al. A fresh look at polymicrobial bloodstream infection in cancer patients. PLoS One 12, e0185768 (2017).
- Montassier E et al. Recent changes in bacteremia in patients with cancer: a systematic review of epidemiology and antibiotic resistance. Eur J Clin Microbiol Infect Dis 32, 841–850 (2013).
- Antimikroobse ravimresistentsuse seire Eestis. Terviseamet;2022. chrome- https://www.terviseamet.ee/sites/default/files/Nakkushaigused/Haigestumine/ nakkush_statistika/antimikroobse_resistentsuse_seire_eestis_2022.pdf
- Paul M et al. Beta-lactam versus beta-lactam-aminoglycoside combination therapy in cancer patients with neutropenia. Cochrane Database Syst Rev. CD003038 (2013). doi:10.1002/14651858.CD003038.pub2
- Paul M et al. Beta lactam antibiotic monotherapy versus beta lactam-amino- glycoside antibiotic combination therapy for sepsis. Cochrane Database Syst Rev. CD003344 (2014). doi:10.1002/14651858.CD003344.pub3.
- Sjövall F et al. Empirical mono- versus combination antibiotic therapy in adult intensive care patients with severe sepsis – A systematic review with meta-analysis and trial sequential analysis. J Infect 74, 331–344 (2017).
- Ripa M et al. Influence of empirical double-active combination antimicrobial therapy compared with active monotherapy on mortality in patients with septic shock: a propensity score-adjusted and matched analysis. J Antimicrob Chemother 72, 3443–3452 (2017).
- Ong DSY et al. Short-Course Adjunctive Gentamicin as Empirical Therapy in Patients With Severe Sepsis and Septic Shock: A Prospective Observational Cohort Study. Clin Infect Dis 64, 1731–1736 (2017).
- Kumar A et al. Early combination antibiotic therapy yields improved survival compared with monotherapy in septic shock: A propensity-matched analysis*. Crit Care Med 38, 1773–1785 (2010).
- Kumar A et al. A survival benefit of combination antibiotic therapy for serious infections associated with sepsis and septic shock is contingent only on the risk of death: A meta-analytic/meta-regression study. Crit Care Med 38, 1651–1664 (2010).
- Lortholary O et al. The risk and clinical outcome of candidemia depending on underlying malignancy. Intensive Care Med 43, 652–662 (2017).
- Kollef M et al. Septic Shock Attributed to Candida Infection: Importance of Empiric Therapy and Source Control. Clin Infect Dis 54, 1739–1746 (2012).
- Colombo AL et al. Candida and invasive mould diseases in non-neutropenic critically ill patients and patients with haematological cancer. Lancet Infect Dis 17, e344–e356 (2017).
- Bassetti M et al. Invasive mould infections in the ICU setting: complexities and solutions. J Antimicrob Chemother 72, i39–i47 (2017).
- Goldberg E et al. Empirical antifungal therapy for patients with neutropenia and persistent fever: Systematic review and meta-analysis. Eur J Cancer 44, 2192–2203 (2008).
- Chen K et al. Empiric treatment against invasive fungal diseases in febrile neutropenic patients: a systematic review and network meta-analysis. BMC Infect Dis 17, 159 (2017).
- Garnacho-Montero J et al. Impact on hospital mortality of catheter removal and adequate antifungal therapy in Candida spp. bloodstream infections. J Antimicrob Chemother 68, 206–213 (2013).
- Parkins MD et al. Adequacy of empirical antifungal therapy and effect on outcome among patients with invasive Candida species infections. J Antimicrob Chemother 60, 613–618 (2007).
- Farmakiotis D et al. Early initiation of appropriate treatment is associated with increased survival in cancer patients with Candida glabrata fungaemia: a potential benefit from infectious disease consultation. Clin Microbiol Infect 21, 79–86 (2015).
- Lee W et al. An Observational Study on Early Empiric versus Culture- Directed Antifungal Therapy in Critically Ill with Intra-Abdominal Sepsis. Crit Care Res Pract 2014, 479413 (2014).
- Karvellas CJ et al. The impact of delayed biliary decompression and anti- microbial therapy in 260 patients with cholangitis-associated septic shock. Aliment Pharmacol Ther 44, 755–766 (2016).
- Chao WN et al. Impact of timing of surgery on outcome of Vibrio vulnificus- related necrotizing fasciitis. Am J Surg 206, 32–39 (2013).
- Azuhata T et al. Time from admission to initiation of surgery for source control is a critical determinant of survival in patients with gastrointestinal perforation with associated septic shock. Crit Care 18, 1–10 (2014).
- Buck DL et al. Surgical delay is a critical determinant of survival in perforated peptic ulcer. Br J Surg 100, 1045–1049 (2013).
- Rausei S et al. Early Versus Delayed Source Control in Open Abdomen Management for Severe Intra-abdominal Infections: A Retrospective Analysis on 111 Cases. World J Surg 1–6 (2017). doi:10.1007/s00268-017-4233-y.
- Bloos F et al. Impact of compliance with infection management guidelines on outcome in patients with severe sepsis: A prospective observational multi- center study. Crit Care 18 (2014).
- Hecker A et al. The impact of early surgical intervention in free intestinal perforation: A time-to-intervention pilot study. World J Emerg Surg 10 (2015).
- Casserly B et al. Lactate measurements in sepsis-induced tissue hypoperfusion: Results from the surviving sepsis campaign database. Crit Care Med 43, 567–573 (2015).
- Castro R, Kattan E, Ferri G, Pairumani R, Valenzuela ED, Alegría L, Oviedo V, Pavez N, Soto D, Vera M, Santis C, Astudillo B, Cid MA, Bravo S, Ospina- Tascón G, Bakker J, Hernández G. Effects of capillary refill time-vs. lactate- targeted fluid resuscitation on regional, microcirculatory and hypoxia-related perfusion parameters in septic shock: a randomized controlled trial. Ann Intensive Care. 2020 Nov 2;10(1):150.
- Hernández G, Ospina-Tascón GA, Damiani LP, et al. Effect of a Resuscitation Strategy Targeting Peripheral Perfusion Status vs Serum Lactate Levels on 28-Day Mortality Among Patients With Septic Shock: The ANDROMEDA- SHOCK Randomized Clinical Trial. JAMA 2019;321(7):654–664.
- Kattan E, Hernández G, Ospina-Tascón G, Valenzuela ED, Bakker J, Castro R; ANDROMEDA-SHOCK Study Investigators and the Latin America Intensive Care Network (LIVEN). A lactate-targeted resuscitation strategy may be associated with higher mortality in patients with septic shock and normal capillary refill time: a post hoc analysis of the ANDROMEDA- SHOCK study. Ann Intensive Care 2020 Aug 26;10(1):114.
- El-Solh AA et al. Bicarbonate therapy in the treatment of septic shock: a second look. Intern Emerg Med 5, 341–347 (2010).
- Mathieu D et al. Effects of bicarbonate therapy on hemodynamics and tissue oxygenation in patients with lactic acidosis: a prospective, controlled clinical study. Crit Care Med 19, 1352–6 (1991).
- Cooper DJ et al. Bicarbonate does not improve hemodynamics in critically ill patients who have lactic acidosis. A prospective, controlled clinical study. Ann Intern Med 112, 492–8 (1990).
- LeDoux D et al. Effects of perfusion pressure on tissue perfusion in septic shock. Crit Care Med 28, 2729–2732 (2000).
- Asfar P et al. High versus Low Blood-Pressure Target in Patients with Septic Shock N Engl J Med 370, 1583–1593 (2014).
- Lamontagne F et al. Higher versus lower blood pressure targets for vasopressor therapy in shock: a multicentre pilot randomized controlled trial. Intensive Care Med 42, 1–9 (2016).
- De Backer D et al. Comparison of Dopamine and Norepinephrine in the Treatment of Shock. N Engl J Med 362, 779–789 (2010).
- Avni T et al. Vasopressors for the Treatment of Septic Shock: Systematic Review and Meta-Analysis. PLoS One 10, e0129305 (2015).
- Gamper G et al. Vasopressors for hypotensive shock. Cochrane Database Syst Rev 2, CD003709 (2016).
- Gordon AC et al. Levosimendan for the Prevention of Acute Organ Dysfunction in Sepsis. N Engl J Med 375, 1638–1648 (2016).
- Russell JA et al. Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med 358, 877–87 (2008).
- Morelli A et al. Continuous terlipressin versus vasopressin infusion in septic shock (TERLIVAP): A randomized, controlled pilot study. Crit Care 13, 1–14 (2009).
- Zhong L, Ji XW, Wang HL, Zhao GM, Zhou Q, Xie B. Non-catecholamine vasopressors in the treatment of adult patients with septic shock-evidence from meta-analysis and trial sequential analysis of randomized clinical trials. J Intensive Care 2020 Oct 31;8(1):83.
- Khanna A, Ostermann M, Bellomo R. Angiotensin II for the Treatment of Vasodilatory Shock. N Engl J Med 2017 Dec 28;377(26):2604.
- . Sprung CL et al. The Effects of High-Dose Corticosteroids in Patients with Septic Shock. N Engl J Med 311, 1137–1143 (1984).
- . Cronin L et al. Corticosteroid treatment for sepsis: a critical appraisal and meta-analysis of the literature. Crit Care Med 23, 1430–9 (1995).
- . Annane D. Glucocorticoids in the treatment of severe sepsis and septic shock. Curr Opin Crit Care 11, 449–53 (2005).
- . Annane D et al. Guidelines for the diagnosis and management of critical illness-related corticosteroid insufficiency (CIRCI) in critically ill patients (Part I): Society of Critical Care Medicine (SCCM) and European Society of Intensive Care Medicine (ESICM) 2017. Intensive Care Med 43, 1751–1763 (2017).
- . Annane D et al. Corticosteroids Treat. sepsis. Cochrane Database Syst Rev. CD002243 (2015).
- . Venkatesh B et al. Adjunctive Glucocorticoid Therapy in Patients with Septic Shock. N Engl J Med. NEJMoa1705835 (2018). doi:10.1056/NEJ- Moa1705835.
- . Briegel J et al. Stress doses of hydrocortisone reverse hyperdynamic septic shock: a prospective, randomized, double-blind, single-center study. Crit Care Med 27, 723–32 (1999).
- . Annane D et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA 288, 862–71 (2002).
- . Malbrain MLNG et al. Fluid overload, de-resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice. Anestezjol Intens Ter 46, 361–380 (2014).
- . Andrews B et al. Effect of an Early Resuscitation Protocol on In-hospital Mortality Among Adults With Sepsis and Hypotension. JAMA 318, 1233 (2017).
- . Bentzer P et al. Will This Hemodynamically Unstable Patient Respond to a Bolus of Intravenous Fluids? JAMA 316, 1298 (2016).
- . Vincent J-L et al. Textbook of Critical Care 7th Edition. (2016).
- . Marik P et al. Hemodynamic parameters to guide fluid therapy. Ann Intensive Care 1, 1 (2011).
- . Monnet X et al. Prediction of fluid responsiveness: an update. Ann Intensive Care 6, 111 (2016).
- . Eskesen TG et al. Systematic review including re-analyses of 1148 individual data sets of central venous pressure as a predictor of fluid responsiveness. Intensive Care Med 42, 324–332 (2016).
- . Marik PE et al. Does the Central Venous Pressure Predict Fluid Responsiveness? An Updated Meta-Analysis and a Plea for Some Common Sense. Crit Care Med 41, 1774–1781 (2013).
- . Umscheid CA et al. Development, implementation, and impact of an automated early warning and response system for sepsis. J Hosp Med 10, 26–31 (2016).
- . Silverman LZ et al. It takes an intensivist. Am J Surg 201, 320–323 (2011).
- . Zhang Z et al. Lactate Clearance Is a Useful Biomarker for the Prediction of All- Cause Mortality in Critically Ill Patients. Crit Care Med 42, 2118–2125 (2014).
- . Detering KM et al. The impact of advance care planning on end of life care in elderly patients: randomised controlled trial. Bmj 340, c1345–c1345 (2010).
- . Downar J et al. Nonbeneficial treatment Canada: Definitions, causes, and potential solutions from the perspective of healthcare practitioners. Crit Care Med 43, 270–281 (2015).
- .. Hinkle LJ et al. Factors associated with family satisfaction with end-of-life care in the ICU: A systematic review. Chest 147, 82–93 (2015).
- . Kon AA et al. Defining Futile and Potentially Inappropriate Interventions: A Policy Statement from the Society of Critical Care Medicine Ethics Committee. Crit Care Med 44, 1769–1774 (2016).
- . Palliatiivne ravi (II osa). Erakorraliste seisundite käsitlus, elulõpuravi ja palliatiivse ravi korraldus. RJ-Z/50.1-2021. Eesti Haigekassa. 2021.