Kopsu- ja kopsuvälise tuberkuloosi käsitlus (ajakohastatud)
Siinne ravijuhend on 2017. aastal valminud ravijuhendi "Kopsu- ja kopsuvälise tuberkuloosi käsitlus" ajakohastatud versioon.Koostajad
Ravijuhendi töörühma liikmed (2025)
| Lea Pehme (juhataja) | Kopsuarst, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts |
| Manfrid Danilovitš | Kopsuarst, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts |
| Kaja Hurt | Kopsutuberkuloosi osakonna õde, SA Tartu Ülikooli Kliinikum; Eesti Õdede Liit |
| Tiina Kummik | Ühendlabori mükobakterioloogia osakonna juhataja, SA Tartu Ülikooli Kliinikum; Eesti Laborimeditsiini Ühing |
| Anu Kurve | Kopsuarst, SA Põhja-Eesti Regionaalhaigla; Eesti Kopsuarstide Selts |
| Marika Raukas | Infektsionist, AS Lääne-Tallinna Keskhaigla; Eesti Infektsioonhaiguste Selts |
| Kaia Varblane | Perearst, OÜ Pirita-Kose Perearstikeskus; Eesti Perearstide Selts |
| Juta Varjas | Peaspetsialist, Terviseamet |
| Piret Viiklepp | Registrite osakonna juhataja, Tervise Arengu Instituut; Eesti Kopsuarstide Selts; Tallinna Arstide Liit; Eesti Arstide Liit |
Ravijuhendi sekretariaadi liikmed (2025)
| Kai Kliiman (juhataja) | Kopsuarst, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts |
| Elmira Gurbanova | Pulmonoloogia resident, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts |
| Kaarel Kisant | Kopsuarst, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts |
| Kadri Klaos | Laborispetsialist, SA Tartu Ülikooli Kliinikum; Eesti Laborimeditsiini Ühing |
Ravijuhendi metoodiline tugi (2025)
| Terje Tollimägi-Raud | Metoodik, Tartu Ülikool |
Tervisekassa esindaja 2025: Marion Kalju ja Laura-Liisa Liivamägi
Ravijuhendi töörühma liikmed(2017)
| Manfrid Danilovitš (juhataja) | Pulmonoloog, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts |
| Alan Altraja | Professor, Tartu Ülikool; pulmonoloog, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts |
| Kaja Hurt | Vanemõde, SA Tartu Ülikooli Kliinikum kopsutuberkuloosi osakond; Eesti Õdede Liit |
| Veronika Iljina | Pulmonoloog, SA Ida-Viru Keskhaigla; Eesti Kopsuarstide Selts |
| Marika Jürna-Ellam | Laboriarst, SA Põhja-Eesti Regionaalhaigla; Eesti Laborimeditsiini Ühing |
| Tiina Kummik | Ühendlabori mükobakterioloogia osakonna juhataja, SA Tartu Ülikooli Kliinikum; Eesti Laborimeditsiini Ühing |
| Anu Kurve | Pulmonoloog, SA Põhja-Eesti Regionaalhaigla; Eesti Kopsuarstide Selts |
| Tanel Laisaar | Torakaalkirurg, SA Tartu Ülikooli Kliinikum; dotsent, Tartu Ülikool; Eesti Torakaalkirurgide Selts, Eesti Kopsuarstide Selts, Eesti Kudede ja Organite Siirdamise Ühing, Tartu Kirurgide Selts, Eesti Kirurgide Assotsiatsioon |
| Kaie Mõtte | Arendusjuht, Eesti Haigekassa |
| Margit Närska | Pediaater, SA Tartu Ülikooli Kliinikum; Eesti Lastearstide Selts; Eesti Infektsioonhaiguste Selts |
| Lea Pehme | Pulmonoloog, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts |
| Rein Raudsepp | Radioloog, SA Põhja-Eesti Regionaalhaigla; Eesti Radioloogia Ühing |
| Marika Raukas | Infektsionist, AS Lääne-Tallinna Keskhaigla; Eesti Infektsioonhaiguste Selts |
| Merike Toomik | Sisearst, AS Lõuna-Eesti Haigla; Eesti Sisearstide Ühendus, Eesti Hüpertensiooni Ühing |
| Kaia Varblane | Perearst, OÜ Pirita-Kose Perearstikeskus; Eesti Perearstide Selts |
| Piret Viiklepp | Tervise Arengu Instituut, tuberkuloosiregister; Eesti Kopsuarstide Selts, Tallinna Arstide Liit, Eesti Arstide Liit |
| Sirle Võsu | Patsientide esindaja |
| Kai Kliiman (juhataja) | Pulmonoloog, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts |
| Argo Aug | Ravimite ja meditsiiniseadmete talituse spetsialist, Eesti Haigekassa; Tartu Ülikooli Rohuteaduse Selts |
| Katre Jürgenson | Pulmonoloog, SA Tartu Ülikooli Kliinikum; Eesti Kopsuarstide Selts, Eesti Nooremarstide Selts |
| Marju Raukas | Ortopeed, AS Ida-Tallinna Keskhaigla; Eesti Traumatoloogide-Ortopeedide Selts, Eesti AO Alumni Selts, Eesti Nooremarstide Ühendus, Eesti Arstide Liit |
| Maarja Sukles | Üliõpilane, Tallinna Tervishoiu Kõrgkool; Eesti Ämmaemandate Ühing, Eesti Seksuaaltervise Liit |
| Kadri Klaos | Laborispetsialist, SA Tartu Ülikooli Kliinikum; Eesti Laborimeditsiini Ühing |
| Margus Krabi | Uroloog, SA Põhja-Eesti Regionaalhaigla; Eesti Uroloogide Selts |
| Mark Kusnetski | Ortopeed, SA Põhja-Eesti Regionaalhaigla; Eesti Traumatoloogide- Ortopeedide Selts |
| Pille Taba | Professor, Tartu Ülikool; neuroloog, SA Tartu Ülikooli Kliinikum; Ludvig Puusepa Nimeline Eesti Neuroloogide ja Neurokirurgide Selts |
| Kaja-Triin Laisaar | Spetsialist, Tartu Ülikooli peremeditsiini ja rahvatervishoiu instituut |
| Mare Oder | Ravikvaliteedi talituse peaspetsialist, Eesti Haigekassa |
Lühendid ja mõisted
Lühendid
| AGREE | Ravijuhendite hindamise tööriist, ingl Appraisal of Guidelines Research and Evaluation instrument |
| HIV | Inimese immuunpuudulikkuse viirus, ingl human immunodeficiency virus |
| IGRA | Mycobacterium tuberculosis’e gammainterferooni määramine, ingl interferon-gamma release assay |
| KT | Kompuutertomograafia |
| MDR-TB | Multiresistentne tuberkuloos, ingl multidrug-resistant tuberculosis |
| MRT | Magnetresonantstomograafia |
| NAAT | Nukleiinhapete amplifikatsiooni test |
| OKR | Otseselt kontrollitav ravi |
| RR-TB | Rifampitsiin resistentne tuberkuloos |
| TB | Tuberkuloos |
| TNFα | Tuumori nekroosi faktor alfa, ingl tumor necrosis factor alpha |
| UH | Ultraheli |
| WHO | Maailma Terviseorganisatsioon, ingl World Health Organization |
Mõisted
| Abatsilleerumine | Tuberkuloosiravi alustamisel röga mikroskoopia ja külvi positiivse tulemuse muutumine ravi käigus negatiivseks |
| Aktiivne tuberkuloos | Tuberkuloosijuht, mille puhul on raviarst diagnoosinud tuberkuloosi haigestumise mistahes vormis või paikmes, välja arvatud latentse tuberkuloosi juhud. |
| Fenotüübiline ravimitundlikkuse määramine | Meetod, mille abil määratakse bakteri tundlikkus tuberkuloosivastase ravimi suhtes. Selleks hinnatakse mikroobi ellujäämisvõimet kindla ravimikontsentratsiooniga keskkonnas külvimeetodil |
| Genotüübiline ravimitundlikkuse määramine | Meetod, mille abil määratakse bakteri genoomis ravimiresistentsust põhjustavaid mutatsioone. Sellel metoodil põhinevad molekulaarsed testid GeneXpert MTB/RIF Ultra, GeneXpert MTB/ XDR, MTBDRplus, MTBDRsl ja BD MAX MDR- TB |
| Kopsutuberkuloos | Tuberkuloosi vorm, mille puhul on haaratud kopsu parenhüüm ja/või kõri, bronhid, trahhea. Tuberkuloosijuht, kus patsiendil on samal ajal nii kopsuväline kui ka kopsutuberkuloos, loetakse statistiliselt kopsutuberkuloosi juhtude hulka |
| Kopsuväline tuberkuloos | Tuberkuloosi vorm, mille korral võib olla haaratud mistahes paige, välja arvatud kopsu parenhüüm, kõri, bronhid ja trahhea. Kopsuvälise tuberkuloosi hulka kuuluvad ka tuberkuloosne pleuriit ja rindkeresiseste lümfisõlmede tuberkuloos |
| Korduvravi juht | Tuberkuloosiravi on uuesti alustatud inimesel, kes on varem ravi katkestanud või kelle varasem ravi on olnud tulemusteta ehk ebaefektiivne |
| Positiivne külv | Bioloogilise materjali külvist kas tahkel söötmel või vedelsöötmes on isoleeritud ja samastatud tuberkuloositekita |
| Latentne tuberkuloos | Kliiniline seisund, mille korral võib inimese organismis olla eluvõimeline tuberkuloosibakter, kuid ta ei ole haigestunud tuberkuloosi. Kasutatakse ka terminit tuberkuloosi nakatunud. |
| Lähikontaktne | Inimene, kellel on olnud nakkusohtliku tuberkuloosihaigega pikaaegne või sage kokkupuude, nt isik, kellega nakkusohtlik haige koos elab, samuti lähedane sõber, töökaaslane või inimene, kes puutub haigega mingi ühistegevuse käigus sageli kokku |
| Mikroskoopiliselt positiivne analüüs | Bioloogilise materjali mikroskopeerimisel on leitud happekindlaid pulkbaktereid (mükobaktereid). |
| Molekulaarne kiirtest | Uuring, mille korral kasutatakse molekulaarseid meetodeid, nt GeneXpert® MTB/RIF Ultra, GeneXpert MTB/XDR, MTBDRplus, MTBDRsl ja BD MAX MDR-TB |
| Morfoloogiline uuring | Bioloogilise materjali tsütoloogiline või histoloogiline uuring |
| Morfoloogiline kiiruuring | Operatsiooni ajal kiiruuringuna tehtav operatsioonimaterjali tsütoloogiline või histoloogiline uuring |
| Multiresistentne tuberkuloos (MDR-TB) | Tuberkuloosijuht, mille korral on haigustekitaja resistentne tuberkuloosi kahe põhiravimi, isoniasiidi ja rifampitsiini suhtes, samuti võib esineda resistentsus teiste tuberkuloosiravimite suhtes. Kui resistentsus esineb ainult rifampitsiini suhtes (RR-TB), on käsitlus sama nagu MDR-TB korral |
| Mükobakterioloo- giline uuring | Bioloogilise materjali uuring, mille eesmärk on kinnitada tuberkuloosi diagnoos: mikroskoopia, molekulaarne kiirtest, külv tahkel söötmel või vedelsöötmes, mükobakterite samastamine ja ravimitundlikkuse määramine |
| M. tuberculosis’e gammainterferoo-ni määramine (IGRA) | Latentse tuberkuloosi diagnostikas kasutatav laborimeetod, mille abil määratakse patsiendi veres gammainterferooni hulk, mis tekib immuunvastusena M. tuberculosis’e peptiidsetele antigeenidele |
| Nakkusohtlik tuberkuloosihaige | Kopsutuberkuloosiga (sh kõrituberkuloosiga) patsient, kellel on tuvastatud bakteri eritus |
| Otseselt kontrollitav ravi (OKR) | WHO soovitatav tuberkuloosiravi korraldus, mille puhul võetakse ravimeid kogu ravikuuri vältel tervishoiutöötaja kontrolli all |
| Perekontaktne | Inimene, kes viibis 3 kuu jooksul enne käimasoleva ravi algust koos nakkusohtliku kopsutuberkuloosihaigega samades eluruumides vähemalt 8 tundi |
| Ravijärelvalve ekspertrühm | Regulaarselt kooskäiv ekspertrühm, kes koordineerib tuberkuloosialast tegevust Eestis ning nõustab ravimresistentseid ja teisi keerulisi tuberkuloosijuhte. |
| Tuberkuloosihaige kontaktne | Nakkusohtliku tuberkuloosihaigega ühes ruumis viibinud isik (nt pere- või lähikontaktne) |
| Tuberkuloosi profülaktiline ravi | Latentse tuberkuloosi korral määratav ravikuur, mille eesmärk on hoida pärast tuberkuloosibakteriga nakatumist ära tuberkuloosi haigestumine |
| Ravimiresistentne tuberkuloos | Tuberkuloosibakter on resistentne ühe või mitme tuberkuloosiravimi suhtes |
| Ravimitundlik tuberkuloos | Tuberkuloosibakter on tundlik kõigi testitud tuberkuloosiravimite suhtes |
| Ravisoostumus | Patsiendi nõusolek ja koostöövalmidus läbida määratud ravikuur |
| Retsidiivjuht | Haigusjuht, mille puhul haigestub tuberkuloosi inimene, kes on varem tuberkuloosi põdenud, ravi saanud ja paranenud |
| TB-HIV- koinfektsioon |
Haigusjuht, mille korral on patsiendil samaaegselt HIV-nakkus ja tuberkuloos |
| Tuberkuloosi nakatumine | Vt latentne tuberkuloos |
| Tuberkuloosi põhirearea ravimid | Ravimitundliku tuberkuloosi raviks kasutatavad ravimid: isoniasiid, rifampitsiin, etambutool, pürasiinamiid, rifapentiin |
| Tuberkuloosi reservrearea ravimid | ravimiresistentse tuberkuloosi ravis kasutatavad ravimid, mis jaotatakse kolme rühma: A – levofloksatsiin/moksifloksatsiin, bedakviliin, linesoliid B – klofasimiin, tsükloseriin C – delamaniid, pürasiinamiid, imipeneem- tsilastatiin, meropeneem, amikatsiin, protionamiid Klassifitseerimata – pretonamiid |
| Tuberkuliinitest | Aeglast tüüpi allergilisel reaktsioonil põhinev test, mille käigus süstitakse naha sisse mükobakterite puhastatud proteiinderivaate ning hinnatakse tulemust 48–72 tunni pärast. Testi kasutatakse latentse tuberkuloosi diagnoosimiseks. Varasem tuberkuloosivastane vaktsineerimine võib anda valepositiivse vastuse |
Sissejuhatus
Tuberkuloos
Eesti probleem on multiravimiresistentse (MDR) tuberkuloosi suur osakaal. Kui Euroopa Liidus oli Maailma Terviseorganisatsiooni (WHO) andmetel 2021. aastal keskmiselt 3,6% külv-positiivsetest kopsutuberkuloosi juhtudest MDR-TB juhud, siis Eestis oli vastav näitaja 28,4% (3).
Üle 90% Eestis registreeritud tuberkuloosijuhtude puhul on haaratud kopsud, kuid tuberkuloos võib haigusena avalduda ka kopsuvälistes paikmetes. Haiguste Ennetamise ja Tõrje Euroopa Keskuse andmetel on Euroopas keskmine kopsuväliste tuberkuloosivormide osakaal 20% kõigist tuberkuloosijuhtudest, Soomes ja Rootsis on see üle 30% (3).
Tuberkuloosi haigestumise vähenedes ja selle diagnoosimise kahanedes on tekkinud olukord, kus tuberkuloosi diagnoosimine hilineb tavaelanikkonna seas ja riskirühmades eeskätt teadlikkuse vähenemise tõttu nii arst- kui ka elanikkonna hulgas.
Ravijuhendi ajakohastamise vajadus
Võrreldes algse ravijuhendiga käsitletakse detailsemalt tuberkuloosihaige kontaktsete väljaselgitamise ja tervisekontrolli kutsumise korda ning latentse tuberkuloosi ravi.
Ajakohastatava ravijuhendi koostamiseks peeti kokku kümme töörühma koosolekut. Neist esimesel kahel pani töörühm paika, millised algse juhendi koostamise aluseks olnud kliinilised küsimused tuleb avada, võttes arvesse lisandunud uut tõendusmaterjali. Ravijuhendi eesmärgiks on tagada nii kopsu- kui ka kopsuvälise tuberkuloosi varajane diagnoosimine, ravi ning tuberkuloosihaige kontaktsete käsitlus ühtsetel põhimõtetel kõigis raviasutustes. Uuendatud ravijuhend aitab kaasa ravitulemuste paranemisele, seda eelkõige vähendades ravi katkestamisi ja ravi ebaõnnestumist ning aitab tagada tuberkuloosiga patsientide tõenduspõhise ja ajakohase käsitluse Eestis.
Ravijuhendi käsitlusala ja sihtrühm
Ravijuhend on mõeldud kasutamiseks kopsuarstidele, perearstidele ja teistele eriarstidele, samuti õdedele ja Terviseameti spetsialistidele.
Ravijuhendis ei käsitleta detailselt tuberkuloosi medikamentoosset ravi (praegu soovitatavad tuberkuloosiravi skeemid on toodud lisas 6), atüüpiliste mükobakterite põhjustatud haigusi (mükobakterioose), kaasuvate haiguste ning seisundite ravi tuberkuloosiga patsientidel ning tuberkuloosivastast vaktsineerimist.
Ravijuhendi ajakohastamiseks vaatas töörühm läbi algse juhendi koostamisel esitatud kliinilised küsimused ja neile vastamisel antud soovitused ning arutas uue tõendusmaterjali otsimise vajadust. Kui mõne kliinilise küsimuse kohta oli vahepealse kuue aasta jooksul töörühma liikmete hinnangul suure tõenäosusega lisandunud uut tõenduspõhist infot, avati see küsimus uue tõendusmaterjali otsimiseks.
Kokku võttis töörühm arutelu alla neli algse juhendi kliinilist küsimust.
1. Kas kõigil tuberkuloosikahtlusega patsientidel tuleb kasutada bioloogilise materjali uuringuks molekulaarset kiirtesti või mikroskoopilist ja külvimeetodit või kõiki eelnimetatud uuringuid tuberkuloosi diagnoosimiseks?
Algse juhendi kliiniline küsimus 5 avati täielikult võrdlemaks molekulaarse kiirtesti kasutamist mikroskoopilise või külvimeetodiga või kõigi eelnimetatud uuringute kooskasutamisega tuberkuloosi diagnostikas.
2. Kas kõigil tuberkuloosiga patsientidel, kellel molekulaarne kiirtest näitab resistentsust/tundlikkust isoniasiidile ja/või rifampitsiinile, tuleb järgnevalt teha teiste tuberkuloosiravimite suhtes ravimitundlikkust määravad molekulaarsed kiirtestid või mitte parema ravitulemuse saamiseks?
Algse ravijuhendi kliiniline küsimus 7 avati täielikult, kuna vahepeal on kasutusele võetud uusi molekulaarseid kiirteste.
3. Kas kõigile nakkusohtliku tuberkuloosihaige lähikontaktsetele on näidustatud tuberkuloosi profülaktiline ravi või mitte tuberkuloosi haigestumise ennetamiseks?
Algse ravijuhendi kliiniline küsimus 8 avati täielikult. Küsimus avati, kuna latentse tuberkuloosi ravivõimalused on laienenud ja puudus tõenduspõhine profülaktiline ravi MDR-TB kontaktsetele.
4. Kas kõigile latentse tuberkuloosiga patsientidele on näidustatud tuberkuloosi profülaktiline ravi või mitte tuberkuloosi haigestumise ennetamiseks?
Algse ravijuhendi kliiniline küsimus 15 avati täielikult. Küsimus avati, kuna latentse tuberkuloosi ravivõimalused on laienenud.
Lisaks avati kõik kolm eelmise ravijuhendi tervishoiukorralduslikku küsimust.
- Kes määrab ja kes koordineerib tuberkuloosihaige ravi (sh ravijärelevalve eksperdirühma kaasamine)?
- Kes jälgib patsienti pärast tuberkuloosiravi?
- Kes jälgib latentse tuberkuloosiga patsienti?
Ehkki ravijuhendi soovitustes lähtutakse tõenduspõhiste uuringute ja kliinilise praktika parimatest tulemustest, ei asenda see siiski vajadust kohaldada igale patsiendile sobivat lähenemist olenevalt tema tervislikust seisundist. Samuti ei anna ravijuhend üksikasjalikku teavet konkreetsete ravimite kohta. Nende kasutamisel tuleb lähtuda ravimi omaduste kokkuvõtetest (www.ravimiamet.ee).
Ravijuhendi koostamine
Ravijuhendi ajakohastamiseks moodustati eri kutsealade esindajatest koosnev üheksaliikmeline töörühm (koosseis esitatud ravijuhendi alguses), kellest osa liikmeid kuulus ka algse juhendi töörühma. Metoodilist nõu andis Tartu Ülikooli ravijuhendite püsisekretariaadi metoodikanõunik.
Ravijuhendite Nõukoda kinnitas ravijuhendi töörühma lõpliku koosseisu 11. aprillil 2023 (vt ravijuhendi koostajad) ja ravijuhendi käsitlusala 29. augustil 2023. Käsitlusala sisaldas seitset PICO-formaadis kliinilist küsimust ja üheksat tervishoiukorralduslikku küsimust.
Ravijuhendi koostamisel lähtuti Eesti ravijuhendite koostamise käsiraamatu (1) põhimõtetest. Kliiniliste küsimuste arutamiseks ja soovituste sõnastamiseks, tervishoiukorralduslikele küsimustele vastamiseks ja juhendi muude materjalide arutamiseks (patsiendijuhend, lisad jm) pidas töörühm kokku kümme veebikoosolekut ning ühe eraldi koosoleku ravijuhendi rakenduskava koostamiseks. Lisaks toimusid arutelud töörühma liikmetega koosolekutevahelisel ajal elektroonselt. Nii ravijuhendi käsitlusala koostamise eel kui ka edaspidi vaadati iga koosoleku alguses läbi töörühma ja sekretariaadi liikmete võimalike huvide konfliktide deklaratsioonid ja veenduti otsustajate kallutamatuses. Koosolek oli otsustusvõimeline, kui osales vähemalt 3/4 töörühma liikmetest. Vastuvõetud otsused olid üksmeelsed.
Kui juhendi ajakohastamisel läbi töötatud teaduslik jm tõendusmaterjal ei andnud põhjust muuta algses ravijuhendis antud soovitust, siis ajakohastati vaid soovituse sõnastust, et iga soovitus oleks eraldi võetuna üheselt aru saadav ja kõik soovitused oleksid ühtses stiilis.
Kui ajakohastatud ravijuhendis muudeti uue teadusliku tõendusmaterjali põhjal või muudel kaalutlustel soovituse sisu, tehti soovituse juurde märge „[AJAKOHASTATUD 2025]“. Kui koostati täiesti uus soovitus, lisati soovitusele märge „[UUS 2025]“.
Ravijuhendi käsitlusala, täistekst, tõendusmaterjali kokkuvõtte tabelid, soovituste koostamise tabelid, rakenduskava, ravijuhendi koostajate huvide deklaratsioonide kokkuvõte ja töörühma koosolekute protokollid on kättesaadavad veebiaadressil www.ravijuhend.ee.
Pärast ravijuhendi kinnitamist ajakohastatakse seda uue olulise informatsiooni lisandumisel või viie aasta pärast.
Patsiendile mõeldud infomaterjal
Tõendusmaterjali otsimine ja hindamine
- „WHO operational handbook on tuberculosis: module 1: prevention: tuberculosis preventive treatment module 1: prevention: tuberculosis preventive treatment“ (4);
- „WHO consolidated guidelines on tuberculosis: module 2: screening: systematic screening for tuberculosis disease“ (5);
- „WHO consolidated guidelines on tuberculosis. Module 3: Diagnosis – rapid diagnostics for tuberculosis detection 2021 update“ (6);
- „Canadian Tuberculosis Standards - 8th Edition“ (7);
- „Guidelines for Programmatic Management of TB Preventive Treatment in India“ (8);
- „Management of Tuberculosis“ (9).
Iga kliinilise küsimuse kohta koostas sekretariaat tõendusmaterjali kokkuvõtte tabeli ja valmistas ette soovituse koostamise tabeli, kasutades veebipõhist tööriista GRADEpro. Peale teadusliku tõendusmaterjali võttis töörühm kliinilise soovituse koostamisel arvesse ka patsientide eelistusi ja väärtushinnanguid, sekkumise vastuvõetavust kõigile sellega seotud pooltele ning soovitusega kaasneda võivat patsientide ebavõrdsesse olukorda jätmist. Samuti hinnati sekkumise teostatavust Eestis.
Tervishoiukorralduslikele küsimustele vastamiseks pidas töörühm koosolekutel arutelusid, võttes arvesse Tervisekassa esindaja tagasisidet.
Ravijuhendite soovituste aluseks olevad tõendusmaterjali ja soovituste kokkuvõtted leiab veebilehelt www.ravijuhend.ee. Materjalides sisalduvad ka otsingustrateegiad.
Ravijuhendi soovitused
Kopsutuberkuloosi ja tuberkuloosse pleuriidi diagnoosimine |
||
|
1
|
|
Kopsutuberkuloosi ja tuberkuloosse pleuriidi kahtlusega patsiendile tehke rindkere röntgeniülesvõte ja bioloogilise materjali1 mükobakterioloogilised uuringud (mikroskoopia, molekulaarne kiirtest, külv). |
| 2 | |
Kopsutuberkuloosi kahtlusega HIV-nakkusega patsiendile, kelle rindkere röntgeniülesvõte on tuberkuloosile viitava leiuta, tehke rindkere kompuutertomograafiline uuring. |
|
3
|
|
HIV-nakkusega patsiendi puhul, kelle röntgeniülesvõttel ei ole tuberkuloosile viitavat leidu, kaaluge tuberkuloosi kahtluse korral bioloogilise materjali saatmist mükobakterioloogilistele uuringutele. |
|
4
|
|
Kopsutuberkuloosi või tuberkuloosse pleuriidi kahtlusega lapsel peaks kasutama rindkere röntgeniülesvõttele ja bioloogilise materjali mükobakterioloogilistele uuringutele lisaks ka IGRA- ja/või tuberkuliinitesti. |
| 5 | |
Kopsutuberkuloosi või tuberkuloosse pleuriidi esmase analüüsina ärge pigem tehke täiskasvanud patsiendile IGRA- või tuberkuliinitesti. |
| 6
|
|
Ebaselge diagnoosiga patsiendi torakaalkirurgilise operatsiooni materjal saatke morfoloogilisele kiiruuringule. Kui kiiruuring ei anna kindlat diagnoosi või on kopsutuberkuloosi kahtlus, tehke ka mükobakterioloogilised uuringud (mikroskoopia, molekulaarne kiirtest, külv). Nende tegemiseks säilitage osa algsest materjalist histoloogilise kiirtesti vastuse saabumiseni steriilses anumas, kuhu ei tohi lisada formaliini või muud fiksatiivi. |
Kopsuvälise tuberkuloosi diagnoosimine opereeritaval patsiendil |
||
|
7
|
|
Ebaselge diagnoosiga luu-liigesehaiguse tõttu opereeritava patsiendi bioloogiline materjal saatke mükobakterioloogilistele uuringutele (mikroskoopia, molekulaarne kiirtest, külv) ja morfoloogilisele uuringule. Mükobakterioloogiliste uuringute materjalile ärge lisage formaliini või muud fiksatiivi. |
| 8
|
|
Kuse-suguelundite ebaselge diagnoosiga haiguste tõttu opereeritava patsiendi bioloogiline materjal saatke mükobakterioloogilistele uuringutele (mikroskoopia, molekulaarne kiirtest, külv) ja morfoloogilisele uuringule. Mükobakterioloogiliste uuringute materjalile ärge lisage formaliini või muud fiksatiivi. |
Kopsu- ja kopsuvälise tuberkuloosi laboridiagnostika |
||
|
9
|
|
Kopsutuberkuloosi kahtlusega patsiendilt võtke vähemalt kaks rögaproovi ja saatke need mükobakterioloogilistele uuringutele (mikroskoopia, molekulaarne kiirtest, külv). Rögaproov võtke eri päevadel või samal päeval vähemalt tunniajase vahega, sh üks neist hommikul. |
| 10 | |
Tuberkuloosikahtlusega patsiendil, kes ei ole võimeline rögaproovi andma, indutseerige röga. Analüüsiks võib saata ka mao- või bronhiloputusvedelikku või väljaheidet. |
|
11
|
|
Kopsuvälise tuberkuloosi kahtlusega patsiendi haiguskolde bioloogiline materjal saatke mükobakterioloogilistele uuringutele (mikroskoopia, molekulaarne kiirtest, külv) ja morfoloogilisele uuringule. Mükobakterioloogiliste uuringute materjalile ärge lisage formaliini või muud fiksatiivi. |
|
12
|
|
Kopsutuberkuloosi kahtlusega HIV-nakkusega patsiendilt võtke mükobakterioloogilisteks uuringuteks (mikroskoopia, molekulaarne kiirtest, külv) vähemalt kolm rögaproovi eri aegadel. |
|
13
|
|
Kopsutuberkuloosi kahtlusega HIV-nakkusega patsiendilt peaks võtma mükobakterioloogilisteks uuringuteks (mikroskoopia, molekulaarne kiirtest, külv) lisaks rögaproovile ka teisi bioloogilisi materjale (uriin, veri, punktaadid, väljaheide jm). |
|
14
|
|
Kopsutuberkuloosi kahtlusega patsiendi bioloogilisest materjalist tehke molekulaarne kiirtest, külv ja mikroskoopia. [AJAKOHASTATUD 2025]
Tugev positiivne soovitus, kõrge tõendatuse aste |
|
15
|
|
Kopsuvälise tuberkuloosi kahtlusega patsiendi bioloogilisest materjalist tehke molekulaarne kiirtest, külv ja mikroskoopia. [UUS 2025]
Tugev positiivne soovitus, kõrge tõendatuse aste |
| 16 | |
Tuberkuloosi diagnoosimisel kasutage lisaks vedelsöötmele ka tahket söödet. |
| 17
|
|
Aktiivse tuberkuloosiga patsiendile, kelle kiirtesti tulemus näitab isoniasiidi- ja/või rifampitsiiniresistentsust, tehke molekulaarsed kiirtestid teiste tuberkuloosiravimite suhtes. [UUS 2025]
Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 18
|
|
Aktiivse tuberkuloosiga patsiendile, kelle kiirtesti tulemus näitab rifampitsiinitundlikkust, tehke molekulaarne kiirtest isoniasiidi suhtes. [UUS 2025]
Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 19
|
|
Tuberkuloosipatsiendi ravitulemuse hindamiseks ärge kasutage molekulaarseid kiirteste. Kiirteste korrake juhul, kui on kahtlus ravimiresistentsuse mustri muutumises. [UUS 2025]
Praktiline soovitus |
| 20
|
|
Aktiivse tuberkuloosiga patsiendile, kelle molekulaarse kiirtesti tulemus näitab isoniasiidi- ja rifampitsiini tundlikkust, tehke fenotüübiline ravimitundlikkuse test kõigi tuberkuloosi põhirea rea ravimite suhtes. [UUS 2025]
Tugev positiivne soovitus, madal tõendatuse aste |
|
21
|
|
Aktiivse tuberkuloosiga patsiendile, kelle molekulaarse kiirtesti tulemus näitab isoniasiidi- ja rifampitsiini resistentsust, tehke fenotüübiline ravimitundlikkuse test kõigi tuberkuloosi reservrea ravimite suhtes. [UUS 2025]
Tugev positiivne soovitus, madal tõendatuse aste |
| 22
|
|
Aktiivse tuberkuloosiga patsiendi puhul, kelle molekulaarse kiirtesti tulemus näitab isoniasiidi- ja/või rifampitsiini- ja/ või fluorokinolooniresistentsust, ei ole vaja resistentsust nimetatud ravimite suhtes fenotüübilise ravimitundlikkuse testiga kinnitada. [UUS 2025]
Nõrk negatiivne soovitus, madal tõendatuse aste |
Tuberkuloosiravi korraldus |
||
| 23
|
|
Kopsutuberkuloosiga patsiendi ravi alustage statsionaarselt. Nakkusohu kadumisel ja vastunäidustuste puudumisel jätkake ravi ambulatoorselt. Patsiendi statsionaarse ravi jätkamist eelistage järgmistel juhtudel:
|
|
24
|
|
Kopsutuberkuloosi ravi ajal tehke raviefektiivsuse ja bakterierituse hindamiseks iga kuu patsiendi bioloogilise materjali mikroskoopia ja külv, eelistades külvimeetodina vedelsöödet. |
|
25
|
|
Kopsutuberkuloosiga patsiendi ravitulemuse hindamiseks tehke rindkere röntgeniülesvõte teise ja neljanda ravikuu lõpus ning ravi lõppedes. Kui patsiendi üldseisund tuberkuloosiravi ajal ei parane, halveneb või kahtlustatakse tüsistusi, tehke radioloogilisi uuringuid vastavalt vajadusele . |
Jälgimine pärast tuberkuloosiravi |
||
| 26 | |
Pärast edukat tuberkuloosiravi ei pea patsienti jälgima, v.a ravimiresistentse tuberkuloosi, raskete kaasuvate haiguste või halva ravisoostumuse korral. |
| 27
|
|
Ravimiresistentse tuberkuloosiga, MDR-TB-ga, HIV- ga või halva ravisoostumusega patsienti võiks pärast kopsutuberkuloosi ravi jälgida kahe aasta jooksul iga kuue kuu järel, hinnates sümptomite olemasolu, tehes rindkere röntgeniülevõtte ja bioloogilise materjali mükobakterioloogilised uuringud. |
| 28 | |
Tuberkuloosiravi lõppedes õpetage patsienti tundma ära tuberkuloosi retsidiivi sümptomeid ja soovitage tal nende tekkimisel pöörduda arsti poole. |
| 29 | |
Patsiendile, kellel kahtlustate tuberkuloosi retsidiivi, tehke diagnoosi kinnitamiseks paikmele vastavad uuringud, sh mükobakterioloogilised uuringud. |
Tuberkuloosihaige kontaktsete käsitlus |
||
| 30
|
|
Kopsutuberkuloosiga patsiendi lähi- ja perekontaktsed kutsuge tervisekontrolli võimaliku tuberkuloosi nakatumise diagnoosimiseks. [UUS 2025]
Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 31
|
|
Kopsutuberkuloosiga patsiendi lähi- ja perekontaktse võimaliku tuberkuloosi nakatumise diagnoosimiseks eelistage IGRA-testi, vajaduse korral võite teha tuberkuliinitesti või mõlemat. Test tuleks teha vähemalt kaks kuud pärast kokkupuudet. [UUS 2025]
Nõrk positiivne soovitus, madal tõendatuse aste |
| 32
|
|
Kopsutuberkuloosiga patsiendi lähi- ja perekontaktsele, kellel kahtlustate aktiivset tuberkuloosi, tehke kopsude röntgeniülesvõte. [UUS 2025]
Praktiline soovitus |
| 33
|
|
Nakkusohtliku tuberkuloosipatsiendi lähi- või perekontaktsel lapsel (kuni 18-aastane k.a), kellel on diagnoositud latentne tuberkuloos, kaaluge tuberkuloosi profülaktilist ravi. [UUS 2025]
Nõrk positiivne soovitus, madal tõendatuse aste |
| 34
|
|
Nakkusohtliku tuberkuloosihaige lähi- või perekontaktsel täiskasvanul, kellel on diagnoositud latentne tuberkuloos, kaaluge tuberkuloosi profülaktilist ravi. [UUS 2025]
Praktiline soovitus |
|
35
|
|
Enne profülaktilise ravi alustamist tuberkuloosihaige lähi- ja perekontaktsele veenduge, et tal ei ole aktiivset tuberkuloosi. [UUS 2025]
Praktiline soovitus |
36
|
|
Multiravim- või rifampitsiinresistentsele tuberkuloosile eksponeeritud lähikontaktset jälgige kahe aasta vältel pärast arvatavat nakatumist. Lähikontaktsel kellel on diagnoositud latentne tuberkuloos, võib profülaktiliseks raviks kasutada levofloksatsiini iga päev kuue kuu jooksul. Enne ravi alustamist konsulteerida ravijärelvalve ekspertrühmaga. [UUS 2025]
Nõrk positiivne soovitus, mõõdukas tõendatuse aste |
Latentne tuberkuloos |
||
| 37
|
|
Latentse tuberkuloosiga patsiendile, kes saab immunosupres- siivset bioloogilist ravi, on kaasuvate haiguste või nende ravi tõttu immuunkomprimeeritud või on siirdamise ootejärjekor- ras, tehke tuberkuloosi profülaktilist ravi. [AJAKOHASTATUD 2025]
Tugev positiivne soovitus, madal tõendatuse aste |
|
38
|
|
Enne latentse tuberkuloosiga patsiendi profülaktilise ravi alustamist veenduge, et tal ei ole aktiivset tuberkuloosi. [UUS 2025]
Praktiline soovitus |
| 39
|
|
Latentse tuberkuloosiga patsienti, kellel on teadaolev lähi- kontakt MDR-TB-haigega, jälgige kahe aasta vältel pärast arvatavat nakatumist. Tuberkuloosi profülaktiliseks raviks võib kasutada levofloksatsiini iga päev kuue kuu jooksul. Enne ravi alustamist konsulteerida ravijärelevalve ekspertrühmaga. [UUS 2025]
Nõrk positiivne soovitus, mõõdukas tõendatuse aste |
| 40 | |
Latentse tuberkuloosiga patsienti õpetage ära tundma tuberkuloosi sümptomeid ja soovitage tal nende tekkimisel pöörduda arsti poole. |
Ravijuhendi soovitused koos tõendusmaterjali lühikokkuvõtetega
Tuberkuloosi mõiste
Kopsutuberkuloosi sümptom on rohkem kui kaks nädalat kestnud köha (7, 10, 11). Haiguse alguses on köha sageli kuiv, kuid hiljem võib muutuda produktiivseks. Ulatusliku haigusprotsessi korral võivad kaasneda ka veriköha ja rindkerevalu. Lisaks hingamiselunditega seotud sümptomitele võivad kaasneda üldsümptomid: palavik, öine higistamine, isutus ja kehakaalu langus.
Tuberkuloosi haigestumist soodustavad tegurid
Tuberkuloosi haigestumist soodustavate tegurite loetelu (5, 17): Inimeste puhul, kes on hiljuti nakatunud tuberkuloosi:
1. lähikontakt nakkusohtliku tuberkuloosihaigega;
2. immigratsioon kõrge tuberkuloosi haigestumusega piirkonnast;
3. positiivne tuberkuliini- või IGRA test alla 5-aastaste laste puhul
5. kokkupuude kõrge tuberkuloosiriskiga inimestega seoses töö või elukohaga näiteks haiglas, kodutute varjupaigas, kinnipidamisasutuses, hooldekodus jne.
Tuberkuloosi haigestumist soodustavad tegurid:
- HIV-infektsioon,
- narkootikumide tarvitamine,
- silikoos,
- diabeet,
- neerupuudlikkus,
- alatoitumus,
- organisiirdamise järgne seisund,
- pahaloomuline kasvaja,
- pikaaegne süsteemsete kortikosteroidide kasutamine,
- bioloogiline ravi,
- varasem tuberkuloosi põdemine,
- alkoholi kuritarvitamine,
- suitsetamine.
Tuberkuloosi diagnoosimine
Tuberkuloosi diagnoosi kinnitab bioloogilisest materjalist M. tuberculosis’e kompleksi samastamine kas molekulaarsete meetoditega või külvist isoleerides. Tuberkuloosiregistri andmetel ei õnnestunud haigustekitajat isoleerida rohkem kui 25%-l kõigist Eestis aastatel 2021–2022 diagnoositud kopsutuberkuloosijuhtudest (2). Sellistel juhtudel põhines diagnoos iseloomulikul kliinilisel pildil, radioloogilisel leiul ja teiste analoogse kliinilise leiuga haiguste välistamisel. Diagnoosi kinnitas ka tuberkuloosivastaste ravimitega saavutatud hea raviefekt.
Tuberkuloosi esmadiagnostikaks on Eestis kasutusel molekulaarsed kiirtestid Xpert® MTB/RIF Ultra ja BD® MAX MDR-TB. Mõlemad meetodid võimaldavad lisaks M. tuberculosis’e kompleksi DNA molekulaarsele samastamisele tuvastada rifampitsiiniresistentsust põhjustavaid mutatsioone; BD® MAX MDR-TB tuvastab ka isoniasiidiresistentsust põhjustavad mutatsioonid. Nendele kahele meetodile on toetavate meetoditena ravimiresistentsuse tuvastamiseks molekulaarsetest kiirtestidest Eestis veel kasutusel HAIN MTBDRplus V2, HAIN MTBDRsl V2 ja Xpert® MTB/XDR. Kõik Eestis kasutusel olevad molekulaarsed kiirtestid ja nende parameetrid on toodud lisas 5.
Mikroskoopilise uuringu vastus väljastatakse ühe tööpäeva jooksul pärast bioloogilise materjali laborisse jõudmist. Mükobakterite mikroskoopia tulemus on positiivne suure bakterierituse korral. Positiivse vastuse hindamisel kasutatakse skaalat: üksikud, 1+, 2+, 3+. Mikroskoopia abil happekindlate pulkbakterite leidmine ei kinnita tuberkuloosi diagnoosi, kuna tegu võib olla ka atüüpiliste mükobakteritega.
Külvimeetoditest on kasutusel külv tahkel söötmel (Löwensteini-Jenseni munasööde) ja külv vedelsöötmesüsteemis (BACTECTM MGITTM 960). Külvi lõplik vastus saadakse tahke söötme puhul kaheksa nädala jooksul, vedelsöötme korral kuue nädala jooksul. Külvimaterjali saastumise korral tehakse alles jäetud algmaterjalile uus algtöötlus ja külvatakse uuesti, mistõttu loetakse aega uuesti alates külvamisest: kaheksa nädalat tahke ja kuus nädalat vedelsöötme puhul. Külvi positiivsest kasvust teavitatakse koheselt uuringu tellijat kas telefonitsi või väljastatakse vastus kohe pärast kinnitava mikroskoopilise preparaadi vaatamist.
Tuberkuloosi diagnoosi kinnitamiseks tuleb teha patsiendi bioloogilisest materjalist pärinevate happekindlate pulkbakterite samastamine vähemalt M. tuberculosis’e kompleksi tasemele. Juba kinnituse saanud tuberkuloosi diagnoosiga patsiendi positiivset külvi samastatakse tuberkuloosiravi ajal korduvalt vaid juhul, kui morfoloogiliselt või kliiniliselt on põhjust kahtlustada, et patsient on haigestunud mõne muu mükobakteri põhjustatud haigusesse (mükobakterioosi). Samastamiseks on eri meetodite rakendamisega võimalik kasutada patsiendi töötlemata bioloogilist materjali, algtöödeldud bioloogilist materjali ja ka külvis väljakasvanud mikroobikultuuri.
Ravimitundlikkust on Eestis võimalik määrata molekulaarsete meetoditega (loetletud ülal) ja fenotüübilise meetodiga vedelsöötmes (vt lisa 5). Fenotüübilise meetodi puhul külvatakse tuberkuloosibakteri 1/100 lahjendusega puhaskultuur vedelsöötme kontrollkatsutisse ja lahjenduseta puhaskultuur kindla ravimikontsentratsiooniga vedelsöötme katsutisse. Seejärel võrreldakse populatsiooni paljunemisvõimet söötmekatsutis ja ravimita kontrollkatsutis. Kui tuberkuloosibakterite kasv ravimiga söötmekatsutis ületab kasvu kontrollkatsutis, loetakse uuritav populatsioon (tüvi) selle ravimi suhtes resistentseks. Molekulaarsete kiirtestidega tuvastatud rifampitsiini-, isoniasiidi- ja/või fluorokinolooniresistentsust ei pea kinnitama fenotüübilise ravimitundlikkusega. Kõik ülejäänud molekulaarsete meetoditega määratud ravimitundlikkused testitakse aga esimese külvi positiivseks kasvades teist korda ka fenotüübilisel meetodil, et kinnitada tulemust ja saada infot ravimite kohta, mille jaoks molekulaarset meetodit praegu ei kasutata. Informatsioon Eestis ravimitundlikkuse määramiseks kasutatavate meetodite kohta koos testitavate ravimite ja ajakuluga on toodud lisas 5.
Kopsutuberkuloosi ja tuberkuloosse pleuriidi diagnoosimine
|
1
|
|
Kopsutuberkuloosi ja tuberkuloosse pleuriidi kahtlusega patsiendile tehke rindkere röntgeniülesvõte ja bioloogilise materjali1 mükobakterioloogilised uuringud (mikroskoopia, molekulaarne kiirtest, külv). |
Ravijuhendi koostamise käigus tehtud tõendusmaterjali otsingul ei leitud võrdlevaid uuringuid, milles võrreldaks kopsutuberkuloosi diagnostikas rindkere röntgeniülesvõtte ja mükobakterioloogiliste uuringute kasutamise efektiivsust. Uuringute puudumine on tõenäoliselt seotud sellega, et mõlema meetodi samaaegne kasutamine on tuberkuloosi diagnostikas rahvusvaheline standard (11). Ravijuhendi töörühm otsustas konsensuslikult, et kopsutuberkuloosi ja tuberkuloosse pleuriidi diagnoosimiseks peab jätkama senist praktikat, kasutades nii rindkere röntgeniülesvõtet kui ka bioloogilise materjali mükobakterioloogilisi uuringuid. Viimastest peab alati tegema mikroskoopia, molekulaarse kiirtesti ja külvi (vt soovitused 14–15).
Kopsu tuberkuloosi diagnostikas r indkere röntgeniülesvõtte ja mükobakterioloogiliste uuringute samaaegne kasutamine on oluline patsiendi heaolu seisukohast: see vähendab diagnostilist viivitust ja võimaldab saada paremaid ravitulemusi. Samuti ei kaasne sellega lisakulusid. Ka WHO, Suurbritannia ja Põhja-Iiri Ühendkuningriigi, Kanada ning Malaisia ravijuhendites on tugev soovitus kasutada kopsutuberkuloosi ja tuberkuloosse pleuriidi diagnoosimiseks nii rindkere röntgeniülesvõtet kui ka bioloogilise materjali mükobakterioloogilisi uuringuid (7, 9, 10, 18). Soovitus põhineb eksperdiarvamusel, mis tugineb põhiliselt kirjanduse ülevaateartiklitele ja õpikutele.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k1-taiskasvanud“.
| 2 | |
Kopsutuberkuloosi kahtlusega HIV-nakkusega patsiendile, kelle rindkere röntgeniülesvõte on tuberkuloosile viitava leiuta, tehke rindkere kompuutertomograafiline uuring. |
|
3
|
|
HIV-nakkusega patsiendi puhul, kelle röntgeniülesvõttel ei ole tuberkuloosile viitavat leidu, kaaluge tuberkuloosi kahtluse korral bioloogilise materjali saatmist mükobakterioloogilistele uuringutele. |
Madala kvaliteediga süstemaatilises ülevaates, kuhu oli kaasatud 67 uuringut, leiti kahe uuringu (vastavalt 144 ja 133 uuritavat) andmetele tuginedes, et kui täiskasvanud immuunkompetentsete inimeste seast oli kopsutuberkuloosi haigestumise korral rindkere röntgeniülesvõte patoloogiata 1%-l, siis HIV- nakkusega patsientidel oli valenegatiivse rindkere röntgeniülesvõtte osakaal 7−15% (19). Kahes kirjeldavas prospektiivses kohortuuringus (vastavalt 1748 ja 801 uuritavat) leiti, et HIV-nakkusega uuritavatel võib kopsutuberkuloosi haigestumise korral olla patoloogiata rindkere röntgeniülesvõtete osakaal isegi 32−46% (20, 21).
Kui kliiniliselt on tõenäoline kopsutuberkuloosi haigestumine, peab HIV- nakkusega patsiendil patoloogiata rindkere röntgeniülesvõtte korral tegema kopsude kompuutertomograafilise (KT) uuringu ning saatma bioloogilise materjali mükobakterioloogilisele uuringule.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k1-hiv“.
| 4 | Kopsutuberkuloosi või tuberkuloosse pleuriidi kahtlusega lapsel peaks kasutama rindkere röntgeniülesvõttele ja bioloogilise materjali mükobakterioloogilistele uuringutele lisaks ka IGRA- ja/või tuberkuliinitesti. | |
| 5 | Kopsutuberkuloosi või tuberkuloosse pleuriidi esmase analüüsina ärge pigem tehke täiskasvanud patsiendile IGRA- või tuberkuliinitesti. |
2017. aastal koostatud algses ravijuhendis tugineti neid soovitusi andes alljärgnevale tõendusmaterjalile.
Mõõduka kvaliteediga metaanalüüsis käsitleti 27 vaatlusuuringut, kuhu oli kaasatud 590 HIV-negatiivset ja 844 HIV-nakkusega uuritavat (22). Uuringu eesmärk oli võrrelda kahe IGRA testi (T-SPOT.TB® ja QuantiFERON-TB® Gold in-tube) kasutamise efektiivsust tuberkuloosi haigestumise kahtlusega või kinnitatud tuberkuloosi diagnoosiga täiskasvanutel. HIV-nakkusega patsientide hulgas oli testide tundlikkus vastavalt 76% ja 60%, HIV-negatiivsetel 88% ja 84%. Mõlema meetodi spetsiifilisus oli suhteliselt madal kõigi patsientide puhul (vastavalt 61% ja 52%). Statistiliselt ei erinenud IGRA-testi tundlikkus tuberkuliinitesti tundlikkusest.
Mõõduka kvaliteediga metaanalüüsi kaasati 27 uuringut (23), kus kasutati tuberkuloosi haigestumise diagnostikas IGRA-testi verest või vererikastest bioloogilistest materjalidest. Võrreldi kahe IGRA-testi (QuantiFERON-TB® Gold in-tube ja T-SPOT.TB®) spetsiifilisust ja tundlikkust.
Verest määratuna oli meetodite tundlikkus tuberkuloosi haigestumise diagnoosimisel 80% ja 81%, spetsiifilisus vastavalt 79% ja 59%. Teistest vererikastest bioloogilistest materjalidest määratuna oli testide tundlikkus 48% ja 88% ning mõlema meetodi spetsiifilisus 82%. Tuberkuliinitesti tundlikkus oli 65% ja spetsiifilisus 75%.
HIV-nakkusega täiskasvanutel IGRA-testi (QuantiFERON-TB® Gold in-tube ja T-SPOT.TB®) kasutamist hindavasse mõõduka kvaliteediga süstemaatilisse analüüsi oli kaasatud 38 uuringut, milles uuriti 6514 HIV-nakkusega patsienti (24). Esimese puhul oli tundlikkus 61% ja spetsiifilisus 72%, teise puhul tundlikkus 65% ja spetsiifilisus 70%.
Tuberkuliinitesti ja IGRA-testi (QuantiFERON-TB® Gold in-tube) tundlikkus tuberkuloosi haigestumise diagnostikas oli vastavalt 60% ning 67%. Testi T-SPOT. TB® oli võrreldud tuberkuliinitestiga ühes uuringus (n = 13), kus testide tundlikkus oli vastavalt 85% ja 46%.
Kuigi IGRA-testi diagnostiline tundlikkus on kõrgem kui tuberkuliinitestil, ei võimalda kumbki uuring madala spetsiifilisuse tõttu välistada ega kinnitada tuberkuloosi haigestumist. Täiskasvanute puhul ei ole tuberkuloosi haigestumise diagnostikas seega näidustatud nende testide kasutamine lisaks radioloogilistele uuringutele ja bioloogilise materjali mükobakterioloogilistele uuringutele.
Kuna lapselt on rögaproovi võtmine keeruline ja seetõttu tuberkuloosi diagnoosi mükobakterioloogiline kinnitamine raskem, võib lisaks radioloogilisele uuringule ja bioloogilise materjali mükobakterioloogilistele uuringutele kasutada IGRA- ja tuberkuliinitesti.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k1-lapsed ja tb-evsu-k1-pleuriit“.
| 6
|
|
Ebaselge diagnoosiga patsiendi torakaalkirurgilise operatsiooni materjal saatke morfoloogilisele kiiruuringule. Kui kiiruuring ei anna kindlat diagnoosi või on kopsutuberkuloosi kahtlus, tehke ka mükobakterioloogilised uuringud (mikroskoopia, molekulaarne kiirtest, külv). Nende tegemiseks säilitage osa algsest materjalist histoloogilise kiirtesti vastuse saabumiseni steriilses anumas, kuhu ei tohi lisada formaliini või muud fiksatiivi. |
Varasema morfoloogilise diagnoosita patsientide kohta, kellel tehakse torakaalkirurgiline operatsioon ning seejärel diagnoositakse tuberkuloos, ei ole avaldatud süstemaatilisi ülevaateid.
Eesti Tervisekassa andmetel tehti aastatel 2013–2015 torakaalkirurgilisi protseduure 1636 patsiendile, kellest 23-l diagnoositi tuberkuloos ajavahemikus 7 päeva enne operatsiooni kuni 90 päeva pärast kirurgilist protseduuri. Torakaalkirurgide dr Tanel Laisaare ja dr Tõnu Vanakesa eksperdiarvamuse kohaselt suunatakse Eestis aastas umbes 100 varasema morfoloogilise diagnoosita patsienti torakaalkirurgilisele operatsioonile peamiselt pahaloomulise kasvaja kahtluse tõttu. Ravijuhendi töörühma hinnangul on selliste patsientide operatsioonimaterjal vaja saata ka mükobakterioloogilisele uuringule, kui puudub kiirtesti kindel vastus või kui kiirtestiga diagnoositakse kopsutuberkuloos. Kui patsiendil on tuberkuloos, on nii võimalik kinnitada diagnoos ka mikrobioloogiliselt ja määrata haigustekitaja ravimitundlikkus. Mükobakterioloogilisele uuringule saadetavale materjalile ei tohi lisada formaliini või muud fiksatiivi, kuna sellisel juhul pole bakterid enam võimelised paljunema ning kultiveerimisel kasvama, mistõttu jäävad ära ka kõik külvist tehtavad edasised diagnostilised testid. Raviasutuses peaks olema kokku lepitud, kas materjal saadetakse mükobakterioloogia laborisse operatsioonitoast või patoloogiaosakonnast.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k2“.
Kopsuvälise tuberkuloosi diagnoosimine opereeritaval patsiendil
Eestis olid aastatel 2010–2019 kõige sagedasemad kopsuvälise tuberkuloosi vormid luude ja liigeste tuberkuloos (26,5%), pleuriit (23,9%), kuse- ja suguelundite tuberkuloos (18,1%), perifeersete lümfisõlmede tuberkuloos (15,5%), tuberkuloosne meningiit (7,1%) ning intratorakaalne lümfadeniit (3,9%) (26).
Luude ja liigeste tuberkuloosi korral paikneb haigus pooltel juhtudel lülisambas (27). Kaugelearenenud haiguse korral võib tekkida seljaaju või närvijuurte kompressioon koos neuroloogiliste ärajäämanähtudega. Lülisamba tuberkuloosi korral täheldatakse KT-uuringul rinna- või nimmelülide eesosade haaratust lõpp-plaatide piirkonnas. Distsiit koos diskide hävimisega tekib alles haiguse hilises faasis ning sellega võivad kaasneda ka paraspinaalsed abstsessid (28, 29). Magnetresonantstomograafia (MRT) tegemine on näidustatud siis, kui on vaja hinnata seljaaju haaratust. Luutuberkuloosi kahtluse korral soovitatakse bioloogilise materjali saamiseks esmase uuringuna nõelbiopsiat KT kontrolli all nii mükobakterioloogiliseks kui ka morfoloogiliseks uuringuks (20).
Tuberkuloosne artriit on tavaliselt suure liigese (puusa- või põlveliigese) monoartriit, mille sümptomid on turse, valu ja funktsioonipiiratus, kusjuures septilisele artriidile omaseid sümptomeid (punetus ja paikne temperatuuritõus) üldjuhul ei esine. MRT-l on tuberkuloosse artriidi korral näha sünoovia ühtlast mõõdukat paksenemist, millega võivad kaasneda liigeselähedaste pehmete kudede abstsessid. Tuberkuloosse artriidi diagnoosimisel tehakse esmalt sünoviaalvedeliku uuringud (30, 31).
Kuseelundite tuberkuloosi algus on sageli hiiliv, mistõttu hilineb diagnoos tihti. Patsientidel esinevad sageli asümptomaatiline steriilne püuuria, hematuuria ja düsuuria (32). Võivad kaasneda ka lokaalsed sümptomid, nagu valulikkus ja sage urineerimine, kuid kaebused on enamasti mittespetsiifilised ning sarnanevad muudele kroonilistele uroinfektsioonidele. Diagnostiliseks uuringuks kasutatakse sonograafiat, KT-d või MRT-d. Kuseelundite tuberkuloosi kahtluse korral tuleb saata vähemalt kolm eri päevadel antud hommikust uriiniproovi mükobakterioloogilisele uuringule. Uriini külv on M. tuberculosis’e suhtes positiivne 80–90%-l kuseelundite tuberkuloosiga patsientidest (33, 34). Teiste uroinfektsioonide raviks kasutatavad antibiootikumid (eriti fluorokinoloonid) võivad inhibeerida mükobakterite kasvu uriinis. Seetõttu ei tohiks neid preparaate kasutada vähemalt 48 tundi enne mükobakterioloogiliseks uuringuks uriiniproovi võtmist (34).
Suguelundite tuberkuloosi esineb sagedamini naistel ning selle sümptomid võivad olla vaagnapiirkonna valu, menstruaaltsükli ebaregulaarsus ja infertiilsus. Vaagnatuberkuloosiga patsientidest 90−100%-l kaasneb ka munajuhade põletikuline haaratus, kuid vulvovaginaalset haaratust esineb harvem. Meestel on sagedamini haaratud skrootum, tihti esineb ka epididümiiti ja orhiiti, harvem prostatiiti (7).
Seedeelundite tuberkuloosi korral võivad olla haaratud mao-sooletrakt, peritooneum, mesenteriaalsed lümfisõlmed ning väga harva ka parenhümatoossed organid (maks, põrn, pankreas) (35). Mao-sooletrakti tuberkuloosi korral paikneb haigus enamasti ileotsökaal-, jejunoileaal- või anorektaalpiirkonnas, muudes mao-sooletrakti osades esineb tuberkuloosi harva. Kuni 64%-l juhtudest on haaratud ileotsökaalpiirkond ning sellistel juhtudel tuleb tuberkuloosi eristada Crohni tõvest (35, 36). Seedeelundite tuberkuloosi diagnostikas on radioloogiliste uuringute leid mittespetsiifiline ning instrumentaalsete uuringute valik sõltub paikmest (37). Diagnoosi kinnitamiseks on olenevalt paikmest vajalikud rooja, kõhuõõnevedeliku või bioptaadi (või biopsiamaterjali) mükobakterioloogilised ning biopsia morfoloogilised uuringud (38).
Kopsuvälise tuberkuloosi kahtluse korral peab alati tegema rindkere röntgeniülesvõtte võimaliku kaasneva kopsuhaaratuse täpsustamiseks. Vajaduse korral tuleb teha ka KT ja täpsustada patsiendi anamneesis tuberkuloosi varasemat põdemist. Sagedamini esinevate kopsuvälise tuberkuloosi paikmete diagnostikas kasutatavad uuringud on kokkuvõtlikult esitatud lisas 3.
|
7
|
|
Ebaselge diagnoosiga luu-liigesehaiguse tõttu opereeritava patsiendi bioloogiline materjal saatke mükobakterioloogilistele uuringutele (mikroskoopia, molekulaarne kiirtest, külv) ja morfoloogilisele uuringule. Mükobakterioloogiliste uuringute materjalile ärge lisage formaliini või muud fiksatiivi. |
Teaduskirjanduses ei ole avaldatud süstemaatilisi ülevaateid, milles käsitletaks opereeritavatel ebaselge diagnoosiga luu-liigesehaigusega patsientidel tuberkuloosi diagnoosimist.
Tervisekassa andmetel tehti aastatel 2013–2015 2797 patsiendile sellist ortopeedilist operatsiooni, mille käigus oli hüpoteetiliselt võimalik tuberkuloosi diagnoosida (st luu või liigese biopsia, sekvestrektoomia või luutrepanatsioon, liigese sünovektoomia, lülisamba deformatsioonide korrektsioon). Tuberkuloos diagnoositi kahel opereeritud patsiendil.
Ravijuhendi töörühm kaalus tuberkuloosi diagnoosi hilinemisega seotud kahjusid, riske ja soovitusest tulenevaid kulutusi ning leidis, et ebaselge diagnoosiga luu- liigesehaigusega opereeritava patsiendi bioloogiline materjal tuleb saata nii mükobakterioloogilisele kui ka histoloogilisele uuringule. Materjalile ei tohi lisada formaliini või muud fiksatiivi, mis pärsib bakterite kasvu ja välistab seega edasiste diagnostiliste testide tegemise võimaluse.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k3“.
| 8
|
|
Kuse-suguelundite ebaselge diagnoosiga haiguste tõttu opereeritava patsiendi bioloogiline materjal saatke mükobakterioloogilistele uuringutele (mikroskoopia, molekulaarne kiirtest, külv) ja morfoloogilisele uuringule. Mükobakterioloogiliste uuringute materjalile ärge lisage formaliini või muud fiksatiivi. |
Teaduskirjanduses ei ole avaldatud süstemaatilisi ülevaateid, milles käsitletaks opereeritavatel ebaselge diagnoosiga kuse-suguelundihaigusega patsientidel tuberkuloosi diagnoosimist.
Ravijuhendi töörühma hinnangul tuleb sellisel patsiendil teha enne operatsiooni kõik vajalikud radioloogilised ja instrumentaalsed uuringud ning saata kuseelundite tuberkuloosi välistamiseks uriiniproovid (soovituslikult kolmel eri hommikul võetud) mükobakterioloogilisele uuringule. Ebaselge diagnoosiga kuse-suguelundihaiguse tõttu opereeritava patsiendi bioloogiline materjal on vaja saata mükobakterioloogilisele ja histoloogilisele uuringule tuberkuloosi suhtes, sest see vähendab diagnoosi hilinemisega seotud kahjusid ning riske. Materjalile ei tohi lisada formaliini või muud fiksatiivi, mis pärsib bakterite kasvu ja välistab seega edasiste diagnostiliste testide tegemise võimaluse.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k4“.
Kopsu ja kopsuvälise tuberkuloosi laboridiagnostika
|
9
|
|
Kopsutuberkuloosi kahtlusega patsiendilt võtke vähemalt kaks rögaproovi ja saatke need mükobakterioloogilistele uuringutele (mikroskoopia, molekulaarne kiirtest, külv). Rögaproov võtke eri päevadel või samal päeval vähemalt tunniajase vahega, sh üks neist hommikul. |
| 10 | |
Tuberkuloosikahtlusega patsiendil, kes ei ole võimeline rögaproovi andma, indutseerige röga. Analüüsiks võib saata ka mao- või bronhiloputusvedelikku või väljaheidet. |
Hea kvaliteediga metaanalüüsis, mis hõlmas kaheksat uuringut, kuhu oli kaasatud 7771 uuritavat, võrreldi eri päevadel antud rögaproovide mikroskoopilise analüüsi tulemusi kahe samal päeval antud rögaproovi analüüsi tulemustega (39). Kui värviti röga mikroskoopiad Ziehl-Neelseni meetodil ning hinnati valgusmikroskoobiga kahte äigepreparaati, mis olid tehtud kahel eri päeval antud rögaproovidest (standardmikroskoopia) või kahest samal päeval antud rögaproovist, saadi sarnane tundlikkus ja spetsiifilisus. Standardmikroskoopia tundlikkus oli 64% (95% CI 60–69) ja samal päeval antud analüüside mikroskoopia tundlikkus 63% (95% CI 58–68%), spetsiifilisus oli vastavalt 98% (95% CI 97–99) ja 98% (95% CI 97–99).
Sarnased tulemused saadi ka fluorestsentsmikroskoopiat kasutades ja siis, kui hinnati kokku kolme preparaati.
Et tuberkuloosi diagnoosi kinnitamise tõenäosust suurendada, peab jätkama senist praktikat, mille kohaselt saadetakse kopsutuberkuloosi kahtluse puhul mükobakterioloogilisele uuringule vähemalt kaks rögaproovi. Kui patsient ei suuda rögaproovi anda, võib röga indutseerida (vt lisa 4), saata analüüsiks bronhiaspiraati, väljaheidet või lastel maoloputusvedelikku.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k5“.
|
11
|
|
Kopsuvälise tuberkuloosi kahtlusega patsiendi haiguskolde bioloogiline materjal saatke mükobakterioloogilistele uuringutele (mikroskoopia, molekulaarne kiirtest, külv) ja morfoloogilisele uuringule. Mükobakterioloogiliste uuringute materjalile ärge lisage formaliini või muud fiksatiivi. |
Ravijuhendi koostamise käigus tõendusmaterjali otsides ei leitud mükobakterioloogiliste ja morfoloogiliste meetodite võrdlevaid uuringuid kopsuvälise tuberkuloosi diagnostikas.
Töörühm otsustas konsensuslikult, et arvestades patsiendi heaolu, peab kopsuvälise tuberkuloosi diagnostikas jätkama senist praktikat, saates haiguskoldest võetud bioloogilise materjali nii morfoloogilisele kui ka mükobakterioloogilisele uuringule. Morfoloogilisel uuringul on iseloomuliku tsütoloogilise ja histoloogilise leiu alusel võimalik kinnitada tuberkuloosse põletiku esinemine. Mükobakterioloogilised meetodid võimaldavad samastada haigustekitaja ja määrata ravimitundlikkuse. Eriti oluline on mõlema meetodi samaaegne kasutamine bioloogiliste materjalide korral, mille saamine põhjustab patsiendile valu või ebamugavust (näiteks koebiopsia).
Kõiki bioloogilisi materjale saab saata tuberkuloosi kahtluse korral mikroskoopiaks ja külviks. Molekulaarset kiirtesti saab teha kõikidest bioloogilistest materjalidest, välja arvatud verest. Enne külvimeetodi kasutamist ei tohi bioloogilist materjali panna formaliini ega muu fiksatiivi sisse, kuna pärast fiksatiivi lisamist pole bakterid enam võimelised paljunema ning kultiveerimisel kasvama, mistõttu jäävad ära ka kõik külvist tehtavad edasised diagnostilised testid. Ka Suurbritannia ja Põhja-Iiri Ühendkuningriigi, Kanada ning Malaisia ravijuhendites on tugev soovitus kasutada kopsuvälise tuberkuloosi diagnostikas nii morfoloogilisi kui ka mükobakterioloogilisi uuringuid (7, 9, 18). Soovitus põhineb eksperdiarvamusel, mis tugineb põhiliselt kirjanduse ülevaateartiklitele ja õpikutele.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k5“.
| 12 |
|
Kopsutuberkuloosi kahtlusega HIV-nakkusega patsiendilt võtke mükobakterioloogilisteks uuringuteks (mikroskoopia, molekulaarne kiirtest, külv) vähemalt kolm rögaproovi eri aegadel. |
|
13
|
|
Kopsutuberkuloosi kahtlusega HIV-nakkusega patsiendilt peaks võtma mükobakterioloogilisteks uuringuteks (mikroskoopia, molekulaarne kiirtest, külv) lisaks rögaproovile ka teisi bioloogilisi materjale (uriin, veri, punktaadid, väljaheide jm). |
Prospektiivsesse kohortuuringusse kaasati 1060 HIV-nakkusega uuritavat, kes pöördusid HIV-i nõustamiskeskusesse ning kellel ei olnud varem diagnoositud tuberkuloosi haigestumist (40). Aktiivne tuberkuloos diagnoositi 147 (14%) uuritaval, kellest 126-l oli kopsutuberkuloos. Uuringus leiti, et kolmanda rögaproovi mikroskoopial diagnoositi tuberkuloosi rohkem 2%-l (95% CI 0–6%) uuritavatest võrreldes kahe rögaproovi mikroskoopia tegemisega. Külvimeetodil diagnoositi tuberkuloos esimesest rögaanalüüsist 90 (71%) tuberkuloosi haigestunul, teisest analüüsist 21 (17%) ja kolmandast analüüsist 12 (10%) patsiendil. 82 lümfisõlme punktaadist kasvas M. tuberculosis 34 (42%) uuritava külvimaterjalis.
Kuna HIV-nakkusega patsiendi puhul on tuberkuloosi diagnoosi mükobakterioloogiline kinnitamine keerulisem (40), peab saatma tuberkuloosi kahtluse korral mükobakterioloogilistele uuringutele vähemalt kolm rögaproovi ning lisaks teisi bioloogilisi materjale. Selline on ka praegune kliiniline praktika.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k5“.
Aktiivse tuberkuloosi diagnoosi kinnitab haigustekitaja M. tuberculosis’e isoleerimine ja samastamine patsiendi bioloogilisest materjalist. Kogu maailmas on tuberkuloosi diagnoosimisel juba aastakümneid olnud tavapärane praktika mikroskoopiline uuring ja haigustekitaja isoleerimine külvimeetodil.
|
14
|
|
Kopsutuberkuloosi kahtlusega patsiendi bioloogilisest materjalist tehke molekulaarne kiirtest, külv ja mikroskoopia. [AJAKOHASTATUD 2025]
Tugev positiivne soovitus, kõrge tõendatuse aste |
|
15
|
|
Kopsuvälise tuberkuloosi kahtlusega patsiendi bioloogilisest materjalist tehke molekulaarne kiirtest, külv ja mikroskoopia. [UUS 2025]
Tugev positiivne soovitus, kõrge tõendatuse aste |
| 16 | |
Tuberkuloosi diagnoosimisel kasutage lisaks vedelsöötmele ka tahket söödet. |
Teaduskirjanduses ei ole avaldatud süstemaatilisi ülevaateid, mis oleksid võrrelnud tuberkuloosi diagnoosimisel mikroskoopia ja külvimeetodi kasutamise efektiivsust, kuid mikroskoopia tundlikkust ja spetsiifilisust on hinnatud kahes uuringus, kus on seda võrreldud külvimeetodiga.
Kõrge kvaliteediga süstemaatilisse ülevaatesse võeti 45 uuringut, kuhu oli kaasatud 50 015 uuritavat materjali, milles võrreldi fluorestsentsmikroskoopia täpsust valgusmikroskoopia omaga (38). Uuringus leiti, et fluorestsentsmikroskoopia oli valgusmikroskoopiast keskmiselt 10% (95% CI 5–15%; p < 0,001) tundlikum, kuid spetsiifilisus oli kahel meetodil sama (94–100%). Ühe preparaadi hindamine võttis fluorestsentsmikroskoobiga aega ühe minuti, kuid valgusmikroskoobiga neli minutit.
Kõrge kvaliteediga metaanalüüsi kaasati 12 uuringut, milles käsitleti fluorestsentsmikroskoopia tundlikkust ja spetsiifilisust, kasutades referentsina külvi (39). Fluorestsentsmikroskoopia tundlikkus oli 66,9% (95% CI 60,5–72,7%) ja spetsiifilisus 96,8% (95% CI 93,1–98,6%). HIV-nakkusega patsientide seas oli fluorestsentsmikroskoopia tundlikkus 53,0% (95% CI 42,8–63,0%) ja spetsiifilisus 96,1% (95% CI 86,0–99,0%).
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k5“.
Viimastel aastatel on molekulaarsed kiirtestid võetud kliinilises praktikas laialdaselt kasutusele, sest need võimaldavad võrreldes külviga haigustekitajat märgatavalt kiiremini samastada, aktiivset TB-d diagnoosida ja saada esmased andmed haigustekitaja ravimitundlikkuse kohta. Seepärast avati kliiniline küsimus, et selgitada välja, millist diagnostilist meetodit või nende kombinatsiooni tuleks kasutada tuberkuloosi diagnoosimiseks.
Hea kvaliteediga Cochrane’i süstemaatilises ülevaates (41), millesse oli kaasatud 85 uuringut (n = 41 965), leiti, et võrreldes külvimeetodi kasutamisega oli meetodi Xpert MTB/RIF kasutamisel molekulaarse kiirtesti mediaan koondtundlikkus ja
-spetsiifilisus vastavalt 85% ja 98%. Molekulaarse kiirtesti tundlikkus oli kõrgem äiges positiivsetel patsientidel kui äiges negatiivsetel patsientidel (98% vs. 67%). Kopsuvälise tuberkuloosi diagnoosimisel hinnati Xpert MTB/RIF testi tundlikkust hea kvaliteediga Cochrane’i andmebaasi süstemaatilises analüüsis (42). Kõrgeim tundlikkus oli luude ja liigeste tuberkuloosi diagnoosimisel: > 94%. Lümfisõlmede ja neerutuberkuloosi diagnostikas oli molekulaarse kiirtesti tundlikkus > 80% ja meningiidi diagnostikas 71%. Madalaim molekulaarse kiirtesti tundlikkus oli pleura- ning peritoneaalvedeliku korral: vastavalt 50,9% ja 59,2%.
Molekulaarse kiirtesti Xpert MTB/RIF Ultra tundlikkust ja spetsiifilisust hinnati hea kvaliteediga süstemaatilises analüüsis (43), kuhu oli kaasatud 16 uuringut (n = 4488). Näitajad olid vastavalt 87,2% ja 96,5%. Hingamisteedest pärineva bioloogilise materjali kasutamisel olid tundlikkus ja spetsiifilisus vastavalt 88,5% ja 96,7%, kopsuvälise tuberkuloosi korral aga 85,1% ja 95,7%.
Kuna molekulaarse kiirtesti tundlikkus on võrreldes äige-ja külvimeetodiga aktiivse tuberkuloosi diagnoosimisel madalam, jääks üksnes molekulaarse kiirtesti kasutamisel osa tuberkuloosi haigusjuhte diagnoosimata. Molekulaarne kiirtest ei võimalda hinnata ka haigustekitaja eluvõimet ja seetõttu võib see olla varem tuberkuloosi põdenud inimesel valepositiivne. Ka ei võimalda molekulaarne kiirtest hinnata tuberkuloosi haigestunu nakkusohtlikkust. Molekulaarse kiirtesti valepositiivset tulemust võib põhjustada ka bioloogilise materjali saastumine. Lisaks jääks aktiivse tuberkuloosi diagnostikas üksnes molekulaarse kiirtesti kasutamisel diagnoosimata mükobakterioosid.
Seepärast otsustas ravijuhendi töörühm, et tagamaks patsiendi heaolu, peab aktiivse kopsutuberkuloosi ja kopsuvälise tuberkuloosi diagnoosimisel kasutama nii molekulaarset kiirtesti, mikroskoopiat kui ka külvimeetodit. Vedelsöötmes kasvatamine on tahkest söötmest tundlikum ja kiirem ning lühendab diagnoosi kinnitamise aega, kuid tahke sööde on spetsiifilisem. Tuberkuloosi diagnoosimisel kõrgeima spetsiifilisuse ja tundlikkuse saavutamiseks on soovitatav jätkata senist praktikat, mille kohaselt kasutatakse aktiivse tuberkuloosi kahtluse korral külviks samal ajal nii vedelat kui ka tahket söödet.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse 1 TõKo ja SoKo tabeleid.
Eduka tuberkuloosiravi üks nurgakivisid on kiire ja täpne antibiootikumravi. Viimastel aastatel on TB diagnostikasse lisandunud mitu molekulaarset kiirtesti, mis aitavad tuvastada M. tuberculosis’e kompleksi kõrval ka geneetilist ravimiresistentsust ja võimaldavad alustada tänu sellele kiiremini ka MDR-TB- ravi.
| 17
|
|
Aktiivse tuberkuloosiga patsiendile, kelle kiirtesti tulemus näitab isoniasiidi- ja/või rifampitsiiniresistentsust, tehke molekulaarsed kiirtestid teiste tuberkuloosiravimite suhtes. [UUS 2025]
Tugev positiivne soovitus, mõõdukas tõendatuse aste |
|
18 |
|
Aktiivse tuberkuloosiga patsiendile, kelle kiirtesti tulemus näitab rifampitsiinitundlikkust, tehke molekulaarne kiirtest isoniasiidi suhtes. [UUS 2025]
Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 19
|
|
Tuberkuloosipatsiendi ravitulemuse hindamiseks ärge kasutage molekulaarseid kiirteste. Kiirteste korrake juhul, kui on kahtlus ravimiresistentsuse mustri muutumises. [UUS 2025]
Praktiline soovitus |
Seepärast soovitas töörühm kasutada molekulaarseid kiirteste kõikide tuberkuloosiravis kasutatavate ravimite resistentsuse usaldusväärseks tuvastamiseks. Molekulaarse kiirtestiga (Xpert® MTB/RIF Ultra või BD® MAX MDR-TB) tuvastatud rifampitsiiniresistentsuse korral on põhjendatud kohe MDR-TB-ravi alustamine (48). Samas nendib töörühm, et ükski selline kiirtest ei võimalda määrata bakteri eluvõimelisust, mistõttu ei tohi ühtegi molekulaarset testi kasutada ravitulemuse hindamiseks. Eestis M. tuberculosis’e ravimitundlikkuse määramiseks kasutatavate testide võrdlus on esitatud lisas 5.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse 2 TõKo ja SoKo tabeleid.
| 20 |
Aktiivse tuberkuloosiga patsiendile, kelle molekulaarse kiirtesti tulemus näitab isoniasiidi- ja rifampitsiini tundlikkust, tehke fenotüübiline ravimitundlikkuse test kõigi tuberkuloosi põhirea rea ravimite suhtes. [UUS 2025] |
|
| 21 |
Aktiivse tuberkuloosiga patsiendile, kelle molekulaarse kiirtesti tulemus näitab isoniasiidi- ja rifampitsiini resistentsust, tehke fenotüübiline ravimitundlikkuse test kõigi tuberkuloosi reservrea ravimite suhtes. [UUS 2025] |
|
| 22 |
Aktiivse tuberkuloosiga patsiendi puhul, kelle molekulaarse kiirtesti tulemus näitab isoniasiidi- ja/või rifampitsiini- ja/ või fluorokinolooniresistentsust, ei ole vaja resistentsust nimetatud ravimite suhtes fenotüübilise ravimitundlikkuse testiga kinnitada. [UUS 2025] Nõrk negatiivne soovitus, madal tõendatuse aste |
Seepärast otsustas töörühm ravijuhendi ajakohastamisel leitud tõendusmaterjalile tuginedes, et tundliku molekulaarse kiirtesti tulemuse korral alustatakse ravi testitulemuse alusel, kuid kõikidele raviskeemis olevatele ravimitele määratakse ka fenotüübiline ravimitundlikkus. Kui molekulaarne kiirtest ei ole tuvastanud rifampitsiiniresistentsust, tuleb siiski teha kiirtest ka isoniasiidiresistentsuse määramiseks, kuna haigus võib olla põhjustatud isoniasiidi monoresistentsest tüvest, mis on seotud halvema ravitulemusega (5). Kui molekulaarse kiirtestiga on tuvastatud isoniasiidi- ja rifampitsiiniresistentsus, tuleb lisaks teha molekulaarsed kiirtestid ka teiste ravimite suhtes ning fenotüübiline ravimitundlikkuse test kõigi reservravimite suhtes. Fenotüübilise ravimitundlikkuse testiga ei ole vaja korrata vaid molekulaarset kiirtesti, millega on tuvastatud isoniasiidi- ja/või rifampitsiini- ja/või fluorokinolooniresistentsus.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse 3 TõKo ja SoKo tabeleid.
Tuberkuloosiravi
| 23
|
|
Kopsutuberkuloosiga patsiendi ravi alustage statsionaarselt. Nakkusohu kadumisel ja vastunäidustuste puudumisel jätkake ravi ambulatoorselt. Patsiendi statsionaarse ravi jätkamist eelistage järgmistel juhtudel:
|
Mõõduka kvaliteediga süstemaatilises analüüsis (50), kuhu oli kaasatud 35 uuringut 14 478 uuritavaga, võrreldi tuberkuloosiravi tulemusi statsionaarse ja ambulatoorse ravi puhul. Uuringus ei leitud statistiliselt olulist erinevust haiglaravi ja ambulatoorse ravi vahel ei haigusest paranemises, suremuses, mitteefektiivses ravis ega ka ravi katkestamises.
Ka retrospektiivses kohortuuringus (51), milles osales 355 tuberkuloosihaiget, kellest 219 alustasid ravi statsionaaris ja jätkasid ambulatoorselt ning 136 olid kogu ravikuuri vältel ainult ambulatoorsel ravil, ei leitud eri ravitüüpide vahel statistiliselt olulist erinevust paranemises, ravikuuri lõpetamises, ravi katkestamises, mitteefektiivses ravis ega suremuses.
MDR-TB-patsientide hulgas tehtud retrospektiivses kohortuuringus, mis kaasas 81 uuritavat (52), leiti, et patsientidel, kes olid saanud vähemalt osaliselt statsionaarset ravi spetsiaalses tuberkuloosikeskuses, oli ravikuuri lõpetamise määr märkimisväärselt kõrgem kui ainult ambulatoorsel ravil viibinud patsientidel (79% vs. 48%; p< 0,001).
Puudub kvaliteetne tõendusmaterjal selle kohta, kas tuberkuloosiga patsiendi puhul peaks eelistama ambulatoorset või statsionaarset ravi. Ravijuhendi töörühma hinnangul on tuberkuloosiga kaasnevat nakkusohtu ja Eestis esinevat suurt MDR- TB osakaalu arvestades otstarbekas jätkata senist praktikat, et mikroskoopiliselt positiivse haige tuberkuloosiravi peab alustama statsionaaris. Ka MDR-TB-haigete ravi on soovitatav alustada statsionaarselt, kuna nende raviskeemis on rohkem ravimeid ja seetõttu on neil suurem risk võimalike ravimite kõrvaltoimete tekkeks. Nakkushaiguste ennetamise ja tõrje seaduse kohaselt on võimalik kohaldada tahtest olenematut ravi nakkusohtlikele tuberkuloosihaigetele, kes on keeldunud ravist või rikkunud ravirežiimi (53).
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k9“.
|
24
|
|
Kopsutuberkuloosi ravi ajal tehke raviefektiivsuse ja bakterierituse hindamiseks iga kuu patsiendi bioloogilise materjali mikroskoopia ja külv, eelistades külvimeetodina vedelsöödet. |
Teaduskirjandusest ei leitud süstemaatilisi ülevaateid ega üksikuuringuid, milles võrreldaks mikroskoopia ja külvimeetodi kasutamist tuberkuloosiravi efektiivsuse jälgimiseks. Kaudselt on soovitusega seotud järgnevad uuringud.
Mõõduka kvaliteediga metaanalüüsi kaasati 15 uuringut rifampitsiinile tundlike uute kopsutuberkuloosi juhtudega. Nende puhul kasutati rifampitsiini sisaldavat standardset raviskeemi ja hinnati võimalust ennustada mikroskoopia või külvi positiivse vastuse alusel haiguse retsidiveerumist või mitteefektiivset ravi (54). Uuringus leiti, et ei mikroskoopia ega ka külvi positiivne vastus teise ravikuu lõpus ei suuda ennustada haiguse retsidiivi või mitteefektiivset ravi. Negatiivne vastus teise ravikuu lõpus viitab aga sellele, et tõenäoliselt ei teki patsiendil haiguse retsidiivi või ravi ei ole mitteefektiivne.
Retrospektiivses kohortuuringus, millesse kaasati millesse kaasati 1416 MDR- TB-patsienti, kelle rögaproovi külvi tulemus oli ravi alguses positiivne (55), analüüsiti nelja erinevat MDR-TB-ravi jälgimise strateegiat. Võrreldi 1) igakuist mikroskoopiat, 2) iga kahe kuu tagant külvi tegemist, 3) iga kolme kuu tagant külvi tegemist ning 4) igakuist mikroskoopiat ja külvi (mis oli referentsiks). Uuringu tulemused näitasid, et kui külv tehakse harvem kui kord kuus, pikendab see ravi intensiivset faasi, kuna abatsilleerumist ei tuvastata õigel ajal. Samas leiti, et igakuine mikroskoopia üksi näitas kiiremat abatsilleerumist kui igakuine külv, kuid madalama tundlikkuse tõttu enneaegu.
Teaduskirjanduses ei leitud uuringuid, milles võrreldaks tuberkuloosiravi ajal eri külvimeetodite (tahkel söötmel ja vedelsöötmes) kasutamise efektiivsust. Nende efektiivsust tuberkuloosi diagnoosimisel on võrreldud kahes uuringus.
Kõrge kvaliteediga süstemaatilisse ülevaatesse kaasati 19 uuringut, milles võrreldi täisautomaatse vedelkülvisüsteemi BACTECTM MGITTM 960 diagnostilist täpsust radiomeetrilise süsteemi BACTEC 460TB ja tahke söötme külviga (56). Leiti, et MGIT 960-l ja BACTEC 460-l oli kiirem detekteerimisaeg kui tahke söötme külvil ja need vähendasid valenegatiivsete tulemuste arvu ligikaudu poole võrra.
Prospektiivses kohortuuringus, kuhu kaasati 1267 analüüsitud materjali, võrreldi BACTECTM MGITTM 960 süsteemi ja tahke söötme (Löwenstein-Jensen) külvi võimet detekteerida mükobaktereid (57). Leiti, et esimene tuvastas võrreldes tahke söötme külviga mükobaktereid sagedamini (29,7% vs. 22,8%) ja oli sagedamini saastunud (16,7% vs. 9,3%), samuti võttis sellega positiivse tulemuse saamine vähem aega (mediaan 14 päeva võrreldes 25 päevaga mikroskoopiliselt negatiivsetes proovides).
Kopsutuberkuloosi ravi ajal peab selle tulemuslikkuse õigeaegseks hindamiseks jätkama senist praktikat, tehes üks kord kuus nii mikroskoopia kui ka külvi. Soovitatav on saata iga kuu uuringule kaks bioloogilist materjali (röga või indutseeritud röga). Kui mikroskoopiat ja külvi tehakse harvem, võib see viia mitteefektiivse ravi hilisema avastamiseni ning seega ka halvema ravitulemuseni. Tuberkuloosi diagnoosimisel on vajalik võimalikult kõrge spetsiifilisus. Seetõttu peab diagnoosimisel samal ajal kasutama nii vedelat kui ka tahket söödet, kuid ravi efektiivsuse jälgimisel piisab üksnes vedelsöötme kasutamisest. Mikroskoopia tulemuse negatiivseks muutumine ravi käigus võimaldab hinnata patsiendi nakkusohu möödumist. Kui patsiendil on intensiivse ravifaasi lõpus mikroskoopia ja/või külvi tulemus positiivne, määratakse uuesti ravimitundlikkus ning muudetakse vajaduse korral selle tulemuste alusel raviskeemi. Molekulaarset kiirtesti (Xpert® MTB/RIF) tuberkuloosiravi efektiivsuse jälgimiseks ei kasutata.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet „tb-evsu-k10“.
|
25
|
|
Kopsutuberkuloosiga patsiendi ravitulemuse hindamiseks tehke rindkere röntgeniülesvõte teise ja neljanda ravikuu lõpus ning ravi lõppedes. Kui patsiendi üldseisund tuberkuloosiravi ajal ei parane, halveneb või kahtlustatakse tüsistusi, tehke radioloogilisi uuringuid vastavalt vajadusele . |
Teaduskirjanduses ei ole avaldatud süstemaatilisi ülevaateid, milles käsitletaks rindkere röntgeniülesvõtete tegemise sagedust kopsutuberkuloosi ravi ajal.
Ravijuhendi töörühm soovitab jätkata senist praktikat: teha rindkere röntgeniülesvõte teise ja neljanda ravikuu lõpus ning edaspidi iga kuue ravikuu järel. Sellise sagedusega on võimalik hinnata adekvaatselt patsiendi paranemist, teha negatiivse dünaamika korral lisauuringuid ja korrigeerida vajaduse korral raviskeemi.
Jälgimine pärast tuberkuloosiravi
| 26 | Pärast edukat tuberkuloosiravi ei pea patsienti jälgima, v.a ravimiresistentse tuberkuloosi, raskete kaasuvate haiguste või halva ravisoostumuse korral. | |
| 27 | Ravimiresistentse tuberkuloosiga, MDR-TB-ga, HIV- ga või halva ravisoostumusega patsienti võiks pärast kopsutuberkuloosi ravi jälgida kahe aasta jooksul iga kuue kuu järel, hinnates sümptomite olemasolu, tehes rindkere röntgeniülevõtte ja bioloogilise materjali mükobakterioloogilised uuringud. | |
| 28 | Tuberkuloosiravi lõppedes õpetage patsienti tundma ära tuberkuloosi retsidiivi sümptomeid ja soovitage tal nende tekkimisel pöörduda arsti poole. | |
| 29 | Patsiendile, kellel kahtlustate tuberkuloosi retsidiivi, tehke diagnoosi kinnitamiseks paikmele vastavad uuringud, sh mükobakterioloogilised uuringud. |
2017. aastal koostatud algses ravijuhendis tugineti neid soovitusi andes alljärgnevale tõendusmaterjalile.
Teaduskirjanduses ei ole avaldatud süstemaatilisi ülevaateid, milles käsitletaks patsiendi jälgimist pärast edukat tuberkuloosiravi.
Tuberkuloosiregistri andmetel diagnoositi Eestis aastatel 2013-2022 mitte RR/ MDR TB-d põdevate kopsutuberkuloosi haigete hulgas 159 retsidiivjuhtu ja RR/MDR-TB kopsutuberkuloosi haigete hulgas 70 retsidiivjuhtu (avaldamata andmed, P. Viiklepp Tervise Arengu Instituut, 23.01.2024). Kui mitte RR/MDR- TB-ta patsientide hulgas tekkis haiguse retsidiiv kahe aasta jooksul eelmisest haigusjuhust paranemise või ravikuuri lõpetamise järel 25 juhul ehk 15,7%-l juhtudest, siis RR/MDR-TB-haigete seas oli selliseid patsiente 10 ehk 14,3%. Esmast kopsuvälist tuberkuloosi registreeriti samal ajavahemikul 93 inimesel, kelle hulgast on sel perioodil tekkinud tuberkuloosi retsidiiv ühel patsiendil (1,1%). Kopsuvälise tuberkuloosi retsidiivjuhte diagnoositi 17 patsiendil, kel pärast ravikuuri lõpetamist korduvaid retsidiive ei diagnoositud (2).
Pärast edukat tuberkuloosiravi peab jälgima üksnes patsiente, kellel on riskitegurid korduva retsidiivi tekkeks: varasem halb ravisoostumus (58), ravimiresistentne tuberkuloos ja/või TB-HIV-koinfektsioon (59). Riskirühma patsiente jälgib ravi lõpetamise järel kopsuarst. Kõiki patsiente peab informeerima tuberkuloosi retsidiivile viitavatest sümptomitest ja soovitama nende tekkimisel pöörduda esimesel võimalusel arsti poole (vt lisa 1). Nende sümptomite tekkimisel peab olenevalt paikmest tegema kõik vajalikud uuringud, et retsidiivi diagnoos kinnitada (vt lisa 3). Iga tuberkuloosipaikme korral on oluline saada diagnoosi mükobakterioloogilise kinnitus, kuna see võimaldab määrata M. tuberculosis’e ravimitundlikkuse, mille alusel saab patsiendile koostada efektiivseima raviskeemi.
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtteid „tb-evsu-k13“ ja „tb-evsu-k1“.
Tuberkuloosihaige kontaktsete käsitlus
Kontaktsete uuring aitab varakult diagnoosida ja ravida mitte ainult aktiivse, vaid ka latentse tuberkuloosiga inimesi. Tuberkuloosi nakatunud inimese eluaegne risk edaspidi tuberkuloosi haigestuda on 5–10%, kuid profülaktilise raviga on võimalik seda riski märkimisväärselt vähendada. Tervishoiutöötajate kohustus tuberkuloosihaigega kontaktis olnud inimeste väljaselgitamiseks ja tervisekontrolli kutsumiseks tuleneb nakkushaiguste tõrje ja ennetamise seadusest (§ 6 lg-d 3 ja
4) (60). Sellekohased konkreetsed soovitused on toodud ravijuhendi lisas 8 ja 9.
| 30
|
|
Kopsutuberkuloosiga patsiendi lähi- ja perekontaktsed kutsuge tervisekontrolli võimaliku tuberkuloosi nakatumise diagnoosimiseks. [UUS 2025]
Tugev positiivne soovitus, mõõdukas tõendatuse aste |
Tõendusmaterjalile tuginedes soovitab ka ravijuhendi töörühm teha tervisekontroll kopsutuberkuloosiga patsiendi kõigile lähi- ja perekontaktsetele, et tuvastada võimalik nakatumine või haigestumine ning alustada õigel ajal sobivat ravi.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse 4 TõKo ja SoKo tabeleid.
| 31
|
|
Kopsutuberkuloosiga patsiendi lähi- ja perekontaktse võimaliku tuberkuloosi nakatumise diagnoosimiseks eelistage IGRA-testi, vajaduse korral võite teha tuberkuliinitesti või mõlemat. Test tuleks teha vähemalt kaks kuud pärast kokkupuudet. [UUS 2025] Nõrk positiivne soovitus, madal tõendatuse aste |
| 32
|
|
Kopsutuberkuloosiga patsiendi lähi- ja perekontaktsele, kellel kahtlustate aktiivset tuberkuloosi, tehke kopsude röntgeniülesvõte. [UUS 2025] Praktiline soovitus |
Tõendusmaterjalile tuginedes soovitab ravijuhendi töörühm kopsutuberkuloosi lähikontaktsete puhul eelistada IGRA-testi. Kui pärast seda püsib kliiniline kahtlus aktiivse tuberkuloosi suhtes, tuleb teha ka rindkere röntgeniülesvõte.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse 5 TõKo ja SoKo tabeleid.
Tuberkuloosihaige kontaktsete profülaktiline ravi
|
33 |
|
Nakkusohtliku tuberkuloosipatsiendi lähi- või perekontaktsel lapsel (kuni 18-aastane k.a), kellel on diagnoositud latentne tuberkuloos, kaaluge tuberkuloosi profülaktilist ravi. [UUS 2025]
Nõrk positiivne soovitus, madal tõendatuse aste |
2023. aastal ravijuhendi ajakohastamisel tehtud otsinguga leiti juurde kolm teemakohast uuringut. Hea kvaliteediga Cochrane’i süstemaatilises ülevaates
(72) leiti, et profülaktiline ravi isoniasiidiga vähendas võrreldes platseeboga lähikontaktsete HIV-positiivsete laste seas (n = 240), kes ei saa antiretroviirusravi, tuberkuloosi haigestumist 69% võrra. Samuti vähenes nende suremus 54% võrra. HIV-positiivsete antiretroviirusravi saavate laste hulgas ei leitud aga statistiliselt olulist efekti tuberkuloosi haigestumise vähenemises.
46 kohortuuringuga metaanalüüsis (73) näidati, et profülaktilise ravi (erinevad isoniasiidi- ja rifampitsiinikombinatsioonid) efektiivsus tuberkuloosi haigestumise ennetamisel oli 63% kõigi tuberkuloosihaigega kokkupuutunud laste hulgas. Latentse tuberkuloosita laste hulgas oli efekt 91%.
2018. aastal avaldatud süstemaatilises ülevaates (74) täheldati tuberkuloosi haigestumise ennetamisel soodsat efekti, kui rakendada ravimiresistentse tuberkuloosiga patsientide lähikontaktsetele lastele profülaktilist ravi (RR = 0,21, 95% CI 0,07–0,63). Profülaktilises ravis kasutati erinevaid raviskeeme:
1) ofloksatsiin, etambutool ja suures annuses isoniasiid või 2) suures annuses isoniasiid, pürasiinamiid, etionamiid ja etambutool või 3) suures annuses isoniasiid, pürasiinamiid, etionamiid ja ofloksatsiin.
| 34
|
|
Nakkusohtliku tuberkuloosihaige lähi- või perekontaktsel täiskasvanul, kellel on diagnoositud latentne tuberkuloos, kaaluge tuberkuloosi profülaktilist ravi. [UUS 2025]
Praktiline soovitus |
|
35
|
|
Enne profülaktilise ravi alustamist tuberkuloosihaige lähi- ja perekontaktsele veenduge, et tal ei ole aktiivset tuberkuloosi. [UUS 2025]
Praktiline soovitus |
Enne, kui määrata profülaktiline ravi, tuleb alati välistada tuberkuloosi haigestumine, kuna profülaktilise ravi skeemide kasutamine võib tuberkuloosi haigestumise korral põhjustada haigustekitaja ravimiresistentsust. Latentse tuberkuloosi profülaktilised raviskeemid on 1) isoniasiid iga päev kuus kuud (6H), 2) rifampitsiin iga päev neli kuud (4R), 3) isoniasiid koos rifampitsiiniga iga päev kolm kuud (3HR), 4) isoniasiid koos rifapentiiniga iga päev üks kuu (1HP), 5) levofloksatsiin iga päev kuus kuud (6Lfx), 6) rifapentiin koos isoniasiidiga üks kord nädalas 12 nädalat (3HP), mille korral on soovitav rakendada OKR-i, et vältida ravikatkestusi ja sellest põhjustatud ravimiresistentsust (vt lisa 10). (4)
Ravimiresistentne tuberkuloos on üks peamisi resistentsete mikroobide põhjustatud haigestumuse ja suremuse põhjuseid maailmas. 2023. aastal registreeriti Haiguste Ennetamise ja Tõrje Euroopa Keskuse andmetel (European Centre for Disease Prevention and Control, ECDC) Euroopa Liidu ja Euroopa Majanduspiirkonna (EU/EEA) 29 riigis ligi 39 000 TB juhtu, haigestumuskordaja on 100 000 kohta 8,6. Ravimitundlikkuse andmed olid teada 19 170 juhul ning neist esines RR-TB ja MDR-TB 814 juhul (4,7%).
Kõige suurem RR/MDR-TB osakaal EU/EEA riikidest oli Eestis (22,5%) ja Leedus (17,7%).
2021. aastal registreeritud RR/MDR-TB juhtude ravitulemused (raporteeritud 2023. a) olid paranemine ja/või ravikuuri lõpetamine (56,3%), surm (17,3%), mitteefektiivne ravi (8,0%), jälgimiselt kadunud (8,0%) ja ravitulemus hindamata või ravi jätkus (6,8%).
Kuues riigis saavutati ravimiresistentse tuberkuloosi ravis eesmärk, et vähemalt 75% patsientidest lõpetas ravi edukalt. See näitaja oli Maltal ja Sloveenias 100%, Hollandis 90,9%, Eestis 85% ja Slovakkias 80,0%. Eestis registreeriti 2023. aastal 20, 2022. aastal 24 ja 2021. aastal 25 MDR-TB juhtu.
RR/MDR-TB infektsiooni leviku peatamiseks ühiskonnas on väga oluline rakendada kõiki võimalikke meetmeid, seepärast otsustas töörühm kliinilise küsimuse avada. Siinset kliinilist küsimust käsitleti ka WHO (2024) juhendis „WHO consolidated guidelines on tuberculosis. Module 1: prevention. Tuberculosis preventive treatment, second edition“. WHO juhendis anti tugev soovitus kasutada RR/MDR-TB lähikontaktsetele isikutele tuberkuloosi ennetava ravina kuuekuulist igapäevast levofloksatsiinravi. See soovitus põhineb kahel juhuslikustatud kontrolluuringul TB CHAMP ja V-QUIN, mida WHO analüüsis (4).
| 36 |
|
Multiravim- või rifampitsiinresistentsele tuberkuloosile eksponeeritud lähikontaktset jälgige kahe aasta vältel pärast arvatavat nakatumist. Lähikontaktsel kellel on diagnoositud latentne tuberkuloos, võib profülaktiliseks raviks kasutada levofloksatsiini iga päev kuue kuu jooksul. Enne ravi alustamist konsulteerida ravijärelvalve ekspertrühmaga. [UUS 2025]
Nõrk positiivne soovitus, mõõdukas tõendatuse aste |
Töörühm leidis, et levofloksatsiini kasutamine latentse tuberkuloosi raviks on näidustatud mõningatel bakterioloogiliselt kinnitatud kopsu MDR-TB patsientide lähikontaktsetel, eriti immunosupresseeritud patsientidel. Töörühm otsustas anda nõrga positiivse soovituse, kuna uuringud olid tehtud Lõuna-Aafrikas ja Vietnamis ning tulemused olid esitatud ainult ühe aasta kohta, mistõttu ei saa hinnata profülaktilise ravi pikaajalist mõju. Lisaks otsustati, et enne ravi alustamist tuleb konsulteerida ravijärelevalve ekspertrühmaga. Vaata ka soovitust nr 39.
Lastele ei ole Eestis levofloksatsiini kasutamine näidustatud, mistõttu tuleb enne mittenäidustatud (nn off-label) ravi alustamist hoolikalt kaaluda kasu ja kahju suhet. Ravi alustamine tuleb kooskõlastada ravijärelevalve ekspertrühmaga, otsuse tegemisse peab kaasama ka pediaatri.
Levofloksatsiinravi jälgimiseks ei ole OKR kohustuslik, kuid vajadusel võib rakendada OKR-i erinevaid vorme, näiteks video-OKR-i.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse 6.1 TõKo ja SoKo tabeleid.
Latentne tuberkuloos
| 37
|
|
Latentse tuberkuloosiga patsiendile, kes saab immunosupres- siivset bioloogilist ravi, on kaasuvate haiguste või nende ravi tõttu immuunkomprimeeritud või on siirdamise ootejärjekor- ras, tehke tuberkuloosi profülaktilist ravi. [AJAKOHASTATUD 2025]
Tugev positiivne soovitus, madal tõendatuse aste |
|
38
|
|
Enne latentse tuberkuloosiga patsiendi profülaktilise ravi alustamist veenduge, et tal ei ole aktiivset tuberkuloosi. [UUS 2025]
Praktiline soovitus |
Mõõduka kvaliteediga süstemaatilises ülevaates, millesse kaasati 108 uuringut (75), leiti, et kõrge elatustasemega riikides oli tuberkuloosipatsiendi kontaktsete seas tuberkuloosi haigestumise risk 1,4% (95% CI 1,1–1,8%). Märgatavalt suurem oli tuberkuloosi haigestumise risk HIV-nakkusega kontaktsete seas: 11,4% (95% CI 7,0–18,0).
Mõõduka kvaliteediga metaanalüüsis, mis hõlmas 50 juhuslikustatud ja 13 juhuslikustamata kontrolluuringut (76), täheldati TNF-α inhibiitoritega ravitavate reumatoidartriidi patsientide seas suuremat tuberkuloosi haigestumise riski (RR = 4,03; 95% CI 2,36–6,88) võrreldes reumatoidartriiti põdevate patsientidega, kes ei saanud ravi TNF-α inhibiitoritega. Tuberkuloosi profülaktiline ravi vähendas nelja uuringu andmete põhjal TNF-α inhibiitoritega ravitavate tuberkuloosi nakatunud reumatoidartriidiga patsientide seas tuberkuloosi haigestumist 65% (RR = 0,35; 95% CI 0,15–0,82).
Madala kvaliteediga süstemaatilisse ülevaatesse kaasati 13 jälgimisuuringut 1 786 212 osalejaga, kellest 17 698-l diagnoositi tuberkuloos. Leiti, et diabeedi korral oli tuberkuloosi haigestumise risk suurem (RR = 3,11; 95% CI 2,27–4,26) (77).
Kõrge kvaliteediga Cochrane’i koostöövõrgustiku süstemaatilises ülevaates, millesse kaasati 11 uuringut 73 375 uuritavaga (78), leiti, et tuberkuloosi profülaktiline ravi isoniasiidiga vähendas kahe või enama aasta vältel platseeborühmaga võrreldes tuberkuloosi haigestumise riski 60% (RR = 0,40; 95% CI 0,31–0,52).
Suurim risk pärast tuberkuloosi nakatumist sellesse haigestuda on HIV-nakkusega patsientidel, TNF-α inhibiitoritega ravitavatel ja diabeediga patsientidel.
Tuberkuloosi profülaktilise ravi eesmärk on ennetada pärast nakatumist tuberkuloosi haigestumist. Profülaktilise ravi peab määrama latentse tuberkuloosiga patsiendile, kellel on suurem tuberkuloosi haigestumise risk ning kelle profülaktilisest ravist loodetav kasu ületab võimaliku kahju. Kuna tuberkuloosi profülaktilist ravi tehakse üldjuhul isoniasiidiga, peab arvestama, et ravimi võimalik kõrvaltoime on maksakahjustus, eriti üle 60-aastase patsiendi puhul (79, 80).
Vaata täpsemalt veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtteid „b-evsu-k15“ ja „tb-evsu-k16“.
Enne, kui määrata profülaktiline ravi, tuleb alati välistada tuberkuloosi haigestumine, kuna profülaktilise ravi skeemide kasutamine võib tuberkuloosi haigestumise korral põhjustada haigustekitaja ravimiresistentsust.
RR/MDR-TB infektsiooni leviku peatamiseks ühiskonnas on väga oluline rakendada kõiki võimalikke meetmeid, seepärast otsustas töörühm eraldi välja tuua soovituse tuberkuloosi profülaktiliseks raviks latentse tuberkuloosiga patsiendil, kellel on teadaolev lähikontakt multiravim- või rifampitsiinresistentse tuberkuloosihaigega. Tõendus pärineb kahel juhuslikustatud kontrolluuringul TB CHAMP ja V-QUIN, mida WHO analüüsis ning mis oli aluseks ka soovituse nr 36 andmisel. (4)
| 39
|
|
Latentse tuberkuloosiga patsienti, kellel on teadaolev lähi- kontakt MDR-TB-haigega, jälgige kahe aasta vältel pärast arvatavat nakatumist. Tuberkuloosi profülaktiliseks raviks võib kasutada levofloksatsiini iga päev kuue kuu jooksul. Enne ravi alustamist konsulteerida ravijärelevalve ekspertrühmaga. [UUS 2025]
Nõrk positiivne soovitus, mõõdukas tõendatuse aste |
Töörühm leidis, et levofloksatsiini kasutamine latentse tuberkuloosi raviks on näidustatud mõningatel bakterioloogiliselt kinnitatud kopsu MDR-TB patsientide lähikontaktsetel, eriti immunosupresseeritud patsientidel. Töörühm otsustas anda nõrga positiivse soovituse, kuna uuringud olid tehtud Lõuna-Aafrikas ja Vietnamis ning tulemused olid esitatud ainult ühe aasta kohta, mistõttu ei saa hinnata profülaktilise ravi pikaajalist mõju. Lisaks otsustati, et enne ravi alustamist tuleb konsulteerida ravijärelevalve ekspertrühmaga.
Lastele ei ole Eestis levofloksatsiini kasutamine näidustatud, mistõttu tuleb enne mittenäidustatud (nn off-label) ravi alustamist hoolikalt kaaluda kasu ja kahju suhet. Ravi alustamine tuleb kooskõlastada ravijärelevalve ekspertrühmaga, otsuse tegemisse peab kaasama ka pediaatri.
Levofloksatsiinravi jälgimiseks ei ole OKR kohustuslik, kuid vajadusel võib rakendada OKR-i erinevaid vorme, näiteks video-OKR-i.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse 6.1 TõKo ja SoKo tabeleid.
| 40 | |
Latentse tuberkuloosiga patsienti õpetage ära tundma tuberkuloosi sümptomeid ja soovitage tal nende tekkimisel pöörduda arsti poole. |
Teaduskirjanduses ei ole uuringuid, milles võrreldaks latentse tuberkuloosiga patsientide jälgimisstrateegiaid.
Kuna tuberkuloosi haigestumise risk on suurim nakatumisele järgneva kahe aasta jooksul (12), peab tuberkuloosi nakatunud patsienti haigestumise õigeaegseks avastamiseks jälgima kaks aastat pärast arvatavat nakatumist. Jälgimisperioodil on soovitatav teha rindkere röntgeniülesvõte vähemalt kord aastas. Kui pärast nakatumist püsivad suuremat haigestumisriski põhjustavad seisundid (immuunkomprimeeritus haiguste või nende ravi tõttu, HIV-nakkus jne), püsib ka tuberkuloosi haigestumise risk, mistõttu on soovitatav sellise latentse tuberkuloosiga patsiendi jälgimisperioodi pikendada. Latentse tuberkuloosiga patsiendile peab rääkima tuberkuloosi haigestumisele viitavatest sümptomitest ja soovitama nende tekkimisel pöörduda edasisteks uuringuteks kohe arsti poole (vt lisa 1).
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse 7 TõKo ja SoKo tabeleid.
Lisad
Lisa 1. Aktiivse tuberkuloosi kahtlusega patsiendi käsitluse algoritm
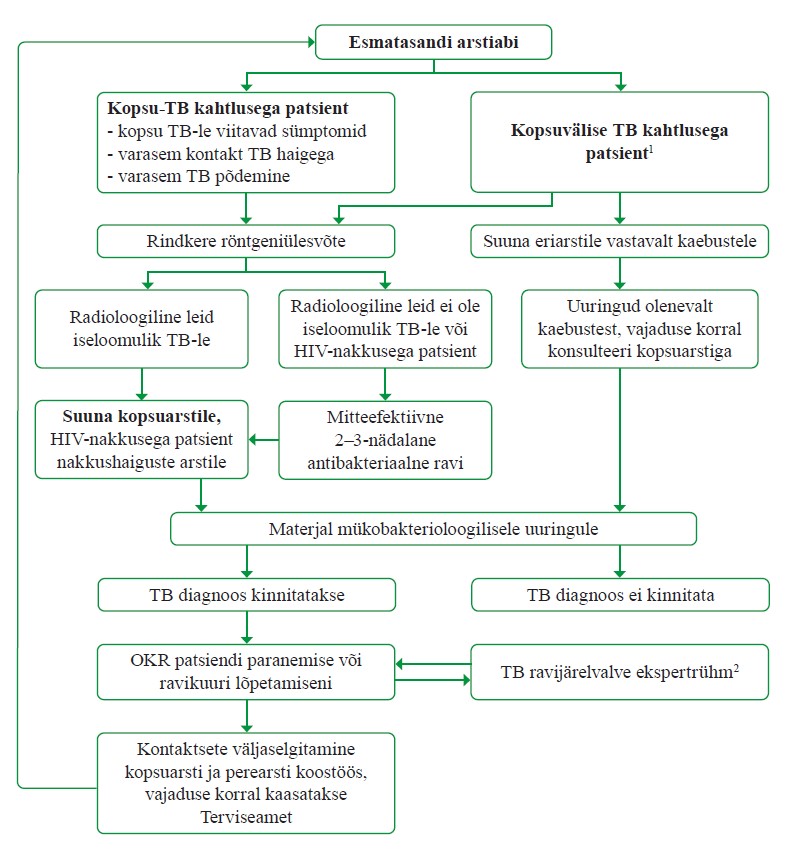
1Sümptomeid vt lisa 3
2Raviskeemi kinnitamiseks suunake kõik RR/MDR-TB patsiendid iga 3 kuu järel. Konsulteerimiseks esitage TB-HIV koinfektsiooni, alaealiste TB ja TB erijuhud.
Lisa 2. Tuberkuloosiravi korraldus
Kui patsiendil on raskusi tervishoiuasutuses kohalkäimisega, soovitame teha kaugvastuvõtte video- või tavakõne teel või kombineerida need koduvisiitidega.
Kaugvastuvõtu korral otsustatakse ravimite kaasaandmise üle iga patsiendi puhul individuaalselt, kuid ravimeid ei anta kaasa rohkem kui kahe nädala jagu. Ravimite kaasaandmisel tuleb jälgida Ravimiameti nõudeid, sh märkida pakendile ravimi nimetus, säilivusaeg ning päevaste annuste suurus ja arv.
Vältimaks ravi katkestamist ja pidurdamaks infektsiooni levikut ühiskonnas on oluline parandada patsientide ravisoostumust. Selleks on pandud kokku motivatsioonipakett, mille eesmärk on toetada patsienti ravil käimisel, tugevdada koostööd ravimeeskonnaga ja vajaduse korral parandada toitumisvõimalusi (82). Täisväärtuslik toitumine aitab kaasa tuberkuloosist paranemisele (83–85). Motivatsioonipakett sisaldub OKR-i teenuse hinnas.
WHO soovitatavad meetodid ravisoostumuse parandamiseks on (82)
- patsiendi ja personali koolitamine ja nõustamine;
- materiaalne toetus ja motiveerimine olenevalt patsiendi vajadustest ja võimalustest (toidupakk, kinkekaart toidu- või tööstuskauba ostmiseks, transporditoetus jne);
- patsiendi psühholoogiline nõustamine;
- ravi jälgimiseks erinevate digivõimaluste kasutamine (telefoni- või videokõned).
Kõik tuberkuloosiravimid ja nendest põhjustatud sagedasemate kõrvaltoimete leevendamiseks kasutatavad ravimid on patsientidele tasuta. Ravimite ostu korraldab Tervisekassa ning patsient saab ravimid tuberkuloosiravi läbiviivatest tervishoiuasutusest.
Tuberkuloosiravis kasutatakse WHO soovitatud raviskeeme (vt lisa 6). Tuberkuloosiravimite sagedasemad kõrvaltoimed ja nende jälgimise juhend on lisas 7.
Ravimresistentse ja komplitseeritud tuberkuloosi haigusjuhud peab ravi alustamiseks, raviefektiivsuse jälgimiseks ja ravikuuri lõpetamiseks suunama tuberkuloosi ravijärelvalve ekspertrühma konsiiliumi istungile, mille tööd koordineerib Tervise Arengu Instituut.
Lisa 3. Kopsuvälise tuberkuloosi diagnostikas kasutatavad uuringud
Uuringute valik sõltub kliinilisest situatsioonist.
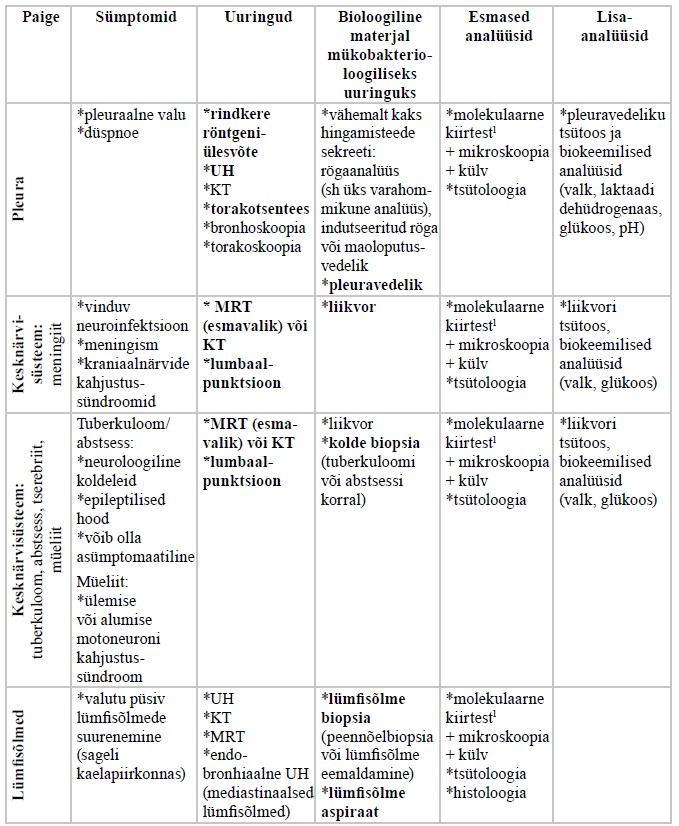
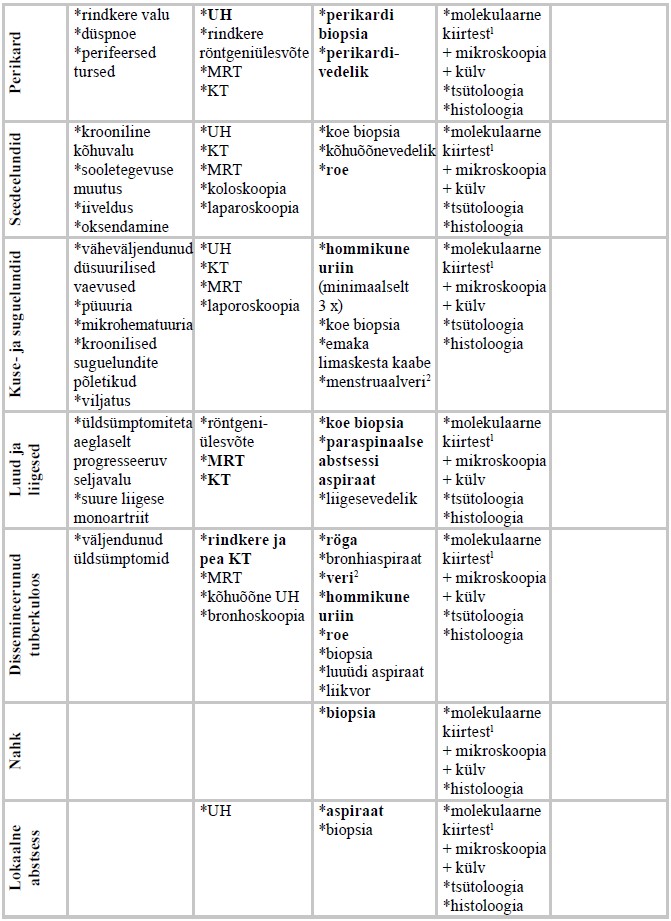 1Molekulaarseid kiirteste tehakse ainult SA TÜK-i ja SA PERH-i mükobakterioloogia laborites, kuna uuritavad materjalid vajavad algtöötlust.
1Molekulaarseid kiirteste tehakse ainult SA TÜK-i ja SA PERH-i mükobakterioloogia laborites, kuna uuritavad materjalid vajavad algtöötlust.2Verest ei saa molekulaarset kiirtesti teha.
Lühendid: KT – kompuutertomograafia, MRT – magnetresonantstomograafia, UH – ultraheli.
Lisa 4. Juhend röga indutseerimiseks
Röga indutseerimisega kaasneb infektsioonioht, mistõttu peab protseduuri tegema hästi ventileeritud ruumis ja personal peab kandma respiraatorit. Pärast protseduuri tuleb ruumi vähemalt 30 minutit tuulutada ja seda ei tohi samal ajal kasutada. Röga indutseerimine võib põhjustada ka obstruktsiooni, eriti astma ja kroonilise obstruktiivse kopsuhaigusega patsiendil. Seetõttu peab alati käepärast olema salbutamooli inhalaator.
Protseduuri kirjeldus
• Selgita patsiendile lühidalt protseduuri kulgu.
• Palu patsiendil oma suu veega loputada ja istet võtta.
• Protseduuri ajal on soovitatav jälgida patsiendi saturatsiooni pulssoksümeetriga (SaO2 < 92% on vastunäidustus röga indutseerimiseks).
• Enne protseduuri manusta patsiendile kaks annust (2 × 100 μg) salbutamooli 10-sekundilise vahega (võib kasutada vahemahutit) ja seejärel oodake viis minutit.
• Anna patsiendile rögatops.
• Aseta nebulisaatorisse 5 ml steriilset (soovitatavalt külmkapist võetud) 3–6% NaCl lahust.
• Palu patsiendil inhaleerida.
• Tee iga viie minuti järel protseduuris paus ja palu patsiendil köhida. Protseduur kestab 15–20 minutit ja analüüsiks piisab 2 ml indutseeritud rögast.
Peata inhalatsioon, kui patsient hakkab produktiivselt köhima. Hingamisraskuse või obstruktsiooni tekkimisel tuleb protseduur kohe lõpetada ja manustada patsiendile esmaabina inhalaatorist 200–400 μg salbutamooli.
Lisa 5. Mycobacterium tuberculosis’e ravimitundlikkuse määramise meetodid
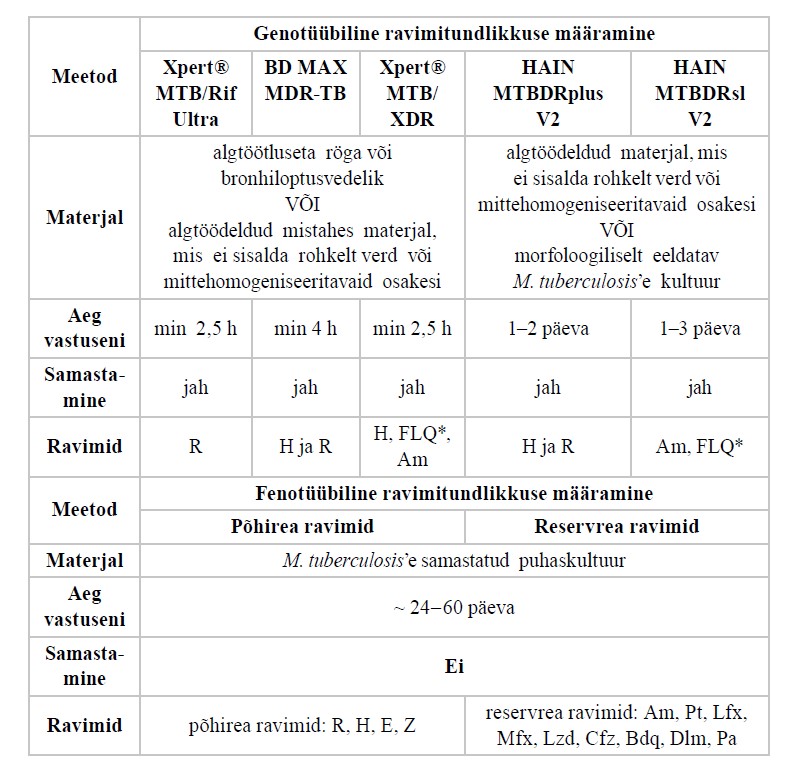
FLQ – fluorokinoloonid (nt. Lfx, Mfx)
Lisa 6. Maailma Terviseorganisatsiooni soovitatavad tuberkuloosiravi skeemid, Eestis kasutusel olevad raviprintsiibid ja ravitulemuste definitsioonid
 E – etambutool, H – isoniasiid, Lfx – levofloksatsiin, Mfx – moksifloksatsiin, P – rifapentiin,
E – etambutool, H – isoniasiid, Lfx – levofloksatsiin, Mfx – moksifloksatsiin, P – rifapentiin,R – rifampitisiin, Z – pürasiinamiid
Tabel 2. Raviskeemid MDR-TB ja RR-TB korral (82)
Raviskeemid valitakse vastavalt ravimitundlikkuse testide tulemustele.
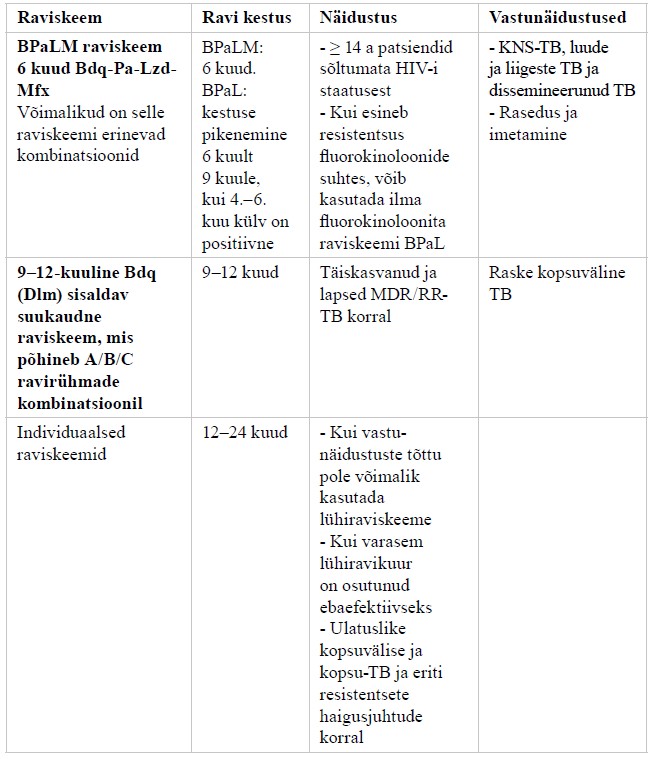 Bdq – bedakviliin, Lzd – linesoliid, Mfx – moksifloksatsiin, Pa – pretomaniid
Bdq – bedakviliin, Lzd – linesoliid, Mfx – moksifloksatsiin, Pa – pretomaniidRaviskeemis peab olema vähemalt neli toimivat reservrea ravimit. Ravimite valikul tuleb juhinduda ravimitundlikkuse andmetest, varasemast tuberkuloosiravist ja võimalikust kõrval- ja koostoimete profiilist.
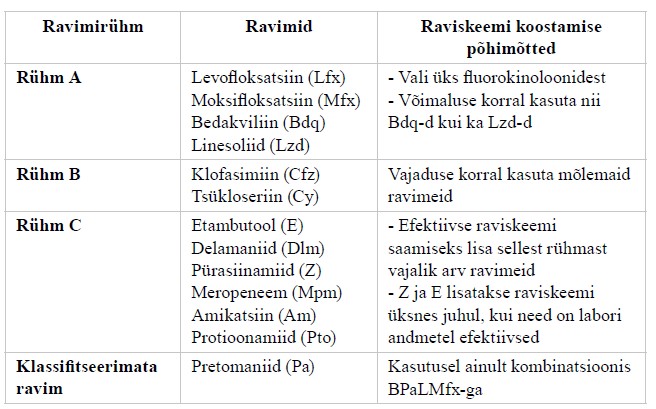 * Võimaluse korral tuleks eelistada ainult suukaudseid preparaate, eriti laste ja noorukite ravis.
* Võimaluse korral tuleks eelistada ainult suukaudseid preparaate, eriti laste ja noorukite ravis.* WHO esialgsete soovituste kohaselt tuleb süstitavatest ravimitest eelistada amikatsiini.
Lisa 7. Tuberkuloosi põhi- ja reservrearavimite sagedasemad kõrvaltoimed
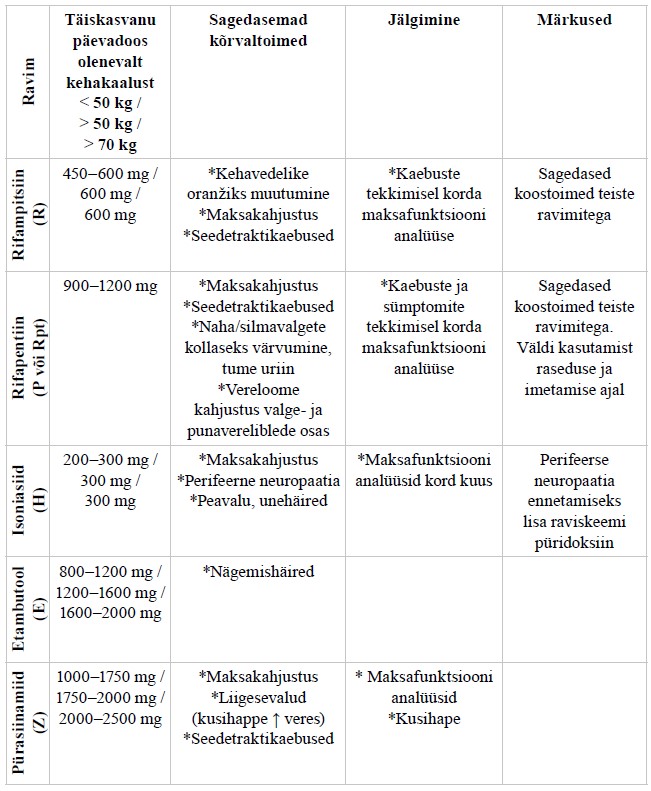
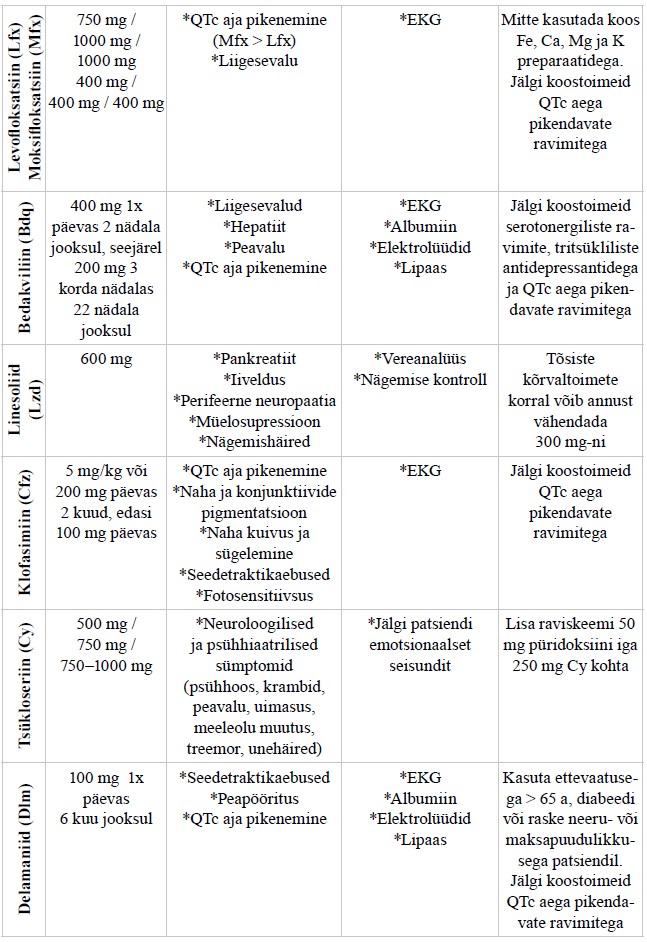
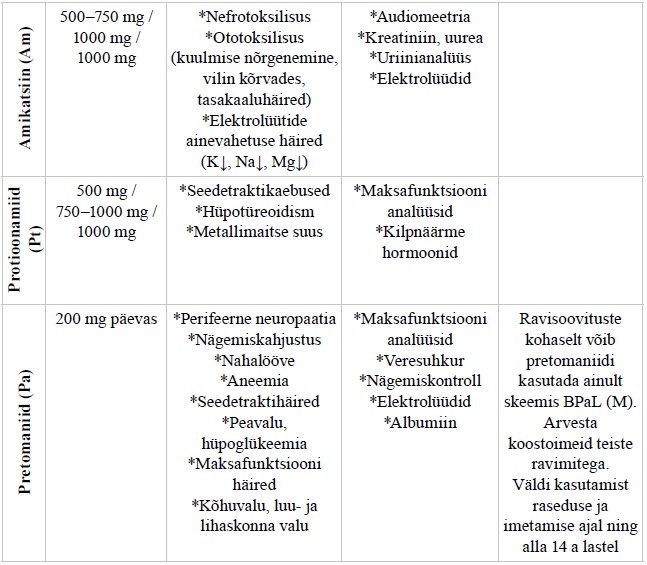
Lisa 8. Tuberkuloosipatsiendi kontaktsete väljaselgitamine ja tervisekontrolli kutsumine
NETS-i § 6 kohaselt on tervishoiutöötaja ülesanded:
• teha nakkushaige või nakkuskahtlase isiku terviseuuring, saata vajaduse korral uurimismaterjal laborisse uuringuteks ja määrata talle ravi;
• uurida nakkushaige nakatumise aega, viisi, nakkusallikat ja nakkuse levitegureid ning selgitada välja nakkushaigega kokkupuutunud isikud;
• teavitada nakkushaigega kokkupuutunud isikut terviseuuringu vajadusest;
• teha nakkushaigele või tema seaduslikule esindajale teatavaks patsiendi nakkusohtlikkus, haiguse leviku teed, ravimata jätmise tagajärjed ja haigele seaduse alusel kohaldatavad piirangud, anda juhiseid nakkuse leviku vältimiseks ning teha edastatud teabe kohta sissekanne ravidokumenti.
1. Kontaktsete väljaselgitamine
• Kui patsiendi ravi alustatakse statsionaarselt, selgitab kontaktsed välja statsionaarses eriarstiabis töötav ja vastava väljaõppe saanud õde või sotsiaaltöötaja. Kui patsient on raskes üldseisundis või sureb enne ravi algust, selgitatakse kontaktsed välja patsiendi pereliikmete, lähedaste või seadusliku esindaja abiga.
• Kui patsiendi ravi alustatakse ambulatoorselt, selgitab kontaktsed välja ambulatoorses eriarstiabis töötav ja vastava väljaõppe saanud õde või sotsiaaltöötaja.
Kontaktsete väljaselgitamist peaks alustama esimesel võimalusel, kui TB diagnoos on kinnitatud, arst on teinud kindlaks patsiendi nakkusohtlikkuse ja määranud nakkusohtliku perioodi.
Kontaktsete väljaselgitamisel soovitame kirjalikult üles loetleda TB-patsiendiga nakkuslikul perioodil kokkupuutunud isikud, teavitada neid nakkusohust ja kutsuda nad tervisekontrolli (telefoni või (e-)posti teel või patsiendi ja tema lähedaste kaudu). Vajaduse korral võib võtta ühendust perearsti või Terviseametiga.
Kontaktsete krüpteeritud nimekiri tuleb edastada ka kontaktse elukohajärgse maakonna kopsukabineti arstile või õele, kes kutsuvad nad tervisekontrolli.
Kontaktsete väljaselgitamise, info edastamise ja tervisekontrolli kutsumise tagamiseks tehakse koostööd perearstikeskuste, maakondade kopsukabinettide, teiste tervishoiuasutuste ja sotsiaaltöötajatega ning Terviseameti regionaal- osakondadega. TB-sse haigestunud patsiendi isikuandmete töötlemisel tuleb lähtuda eriliigiliste andmete töötlemise nõuetest ja kontaktsetele TB-patsiendi isikuandmeid ei avaldata.
Tervisekontrolli tuleb kutsuda kõik kopsu-TB-ga patsientide perekontaktsed. Kui patsiendi TB diagnoos on mükobakterioloogiliselt kinnitatud (äiges ja/või molekulaarse kiirtestiga ning külvimeetodil), laiendatakse tervisekontrolli kutsutavate kontaktsete ringi: lisaks perekontaktsetele selgitatakse välja kõik lähikontaktsed.
Arst selgitab välja TB-patsiendi nakkusohtliku perioodi, mis on tavaliselt kolm kuud, ent erandjuhul, kui köha on kestnud kauem ja kopsudes on laiaulatuslik lagunemistega leid, võib see kesta kuni kuus kuud. Selle info alusel koostab õde nimekirja inimestest, kes on viibinud TB-patsiendiga nakkusohtlikul perioodil samas kinnises ruumis kumulatiivselt rohkem kui 40 tundi, alla 14-aastaste laste puhul rohkem kui 8 tundi. Lähikontaktsete ringi võivad kuuluda töökaaslased, sõbrad-tuttavad, naabrid, pere ja sugulased, huviringide kaaslased jne. Lähikontaktsetele, kes vajavad tervisekontrolli, ei avaldata TB-patsiendi isikuandmeid.
Kui TB-patsient töötab õppe-, hoolekande- või lasteasutuses või on õppe- või lasteasutuse õpilane või hoolekandeasutuse hoolealune, esitab tema raviasutus patsiendi töökoha, õppe- või hoolekandeasutuse esindaja(te) kontaktandmed Terviseameti regionaalosakonnale. Selle alusel teeb Terviseameti regionaalosakonna ametnik visiidid laste-, õppe-, või hoolekandeasutustesse, hindab sealset olukorda, informeerib personali, teeb riskianalüüsi, selgitab välja potentsiaalsed lähikontaktsed ja korraldab koostöös piirkonna kopsu- või perearsti või kopsukabineti õega sealsete lähikontaktsete terviskontrolli NETS-i 4. ja 5. peatüki alusel.
TB-haiget teavitatakse riskianalüüsi vajalikkusest töökohas, õppe-, laste- või hoolekandeasutuses. Riskianalüüsi aitab korraldada asutuses selleks volitatud isik, kellele avaldatakse patsiendi isikuandmed. Ülejäänud lähikontaktsetele TB- patsiendi isikuandmeid avaldada ei tohi.
Kui samas asutuses diagnoositakse tuberkuloos rohkem kui ühel isikul, tuleb kindlasti kaasata Terviseameti töötaja. Muudel juhtudel kaasatakse Terviseamet vajaduse korral.
Kui TB-patsient viibis enne diagnoosi kinnitamist teistes haigla osakondades või tervishoiuasutustes, teeb riskianalüüsi infektsioonikontrolli teenistus koostöös kopsuarstiga. Töö käigus TB-haigega kokku puutunud tervishoiutöötajad läbivad tervisekontrolli üldjuhul oma tervishoiuasutuses ja vastavalt oma asutuse korrale.
Kui TB-haigel on lähikontaktseid (töökaaslased, perekontaktid jt) väljaspool Eestit, edastatakse tema andmed (nimi, ligikaudne nakkusohtlik aeg, töökoht) Terviseametile, kes teavitab välisriigi kontaktasutust varajase hoiatamise ja reageerimise süsteemi (Early Warning Response System, EWRS) kaudu. Välisriigi kontaktsetega tegeleb edasi vastava riigi tervishoiutöötaja.
Kui Eesti kodanik on olnud välismaal lähikontaktis nakkusohtliku TB-haigega, saadetakse selle kohta info lähteriigist EWRS-i kaudu Terviseametile. Terviseamet võtab ühendust kontaktsega ja edastab info ka maakonna kopsuarstile, et korraldada vajaduse korral kontaktse tervisekontroll ja jälgimine.
Kontaktsete väljaselgitamise kohta tehakse märge patsiendi elektroonilisse haigusloosse.
Kui TB-patsient on viibinud nakkuslikul perioodil viimase kolme kuu jooksul üle kaheksa tunni kestnud lennureisil, lähtutakse WHO rahvusvahelisest juhisest (86). Kontaktsete väljaselgitamisega tegelev tervishoiutöötaja uurib välja reisi andmed ja kuupäeva ning edastab info Terviseametile. Terviseamet võtab ühendust reisifirmaga, selgitab välja nakkusohus olnud (nt lennukis samas reas, kaks rida eespool ja kaks rida taga pool reisinud) isikud ning teavitab neid nakkusohust ja tervisekontrolli vajalikkusest. Kui nakkusohus olnud isikud on välisriigi elanikud, teavitatakse välisriiki sellest EWRS-i kaudu. Kontaktsetele TB-patsiendi isikuandmeid ei avaldata.
2. Tuberkuloosi nakkusallika väljaselgitamine
TB nakkusallikas tuleb välja selgitada juhul, kui haigestunud on alla 14-aastane laps (olenemata rahvusest ja sünnikohast). Selleks tuleb esmalt uurida haigestunud lapse pereliikmeid.
Kui pereliikmed on terved, tuleb nakkusallika väljaselgitamiseks võimalike lähteisikute ringi laiendada (vanavanemad, lapsehoidja, naabrid, sõbrad, lähedased peretuttavad, sugulased, kooli või koolieelse lasteasutuse personal jt).
Lisa 9. Tuberkuloosipatsiendi kontaktsete väljaselgitamise ja tervisekontrolli kutsumise algoritm
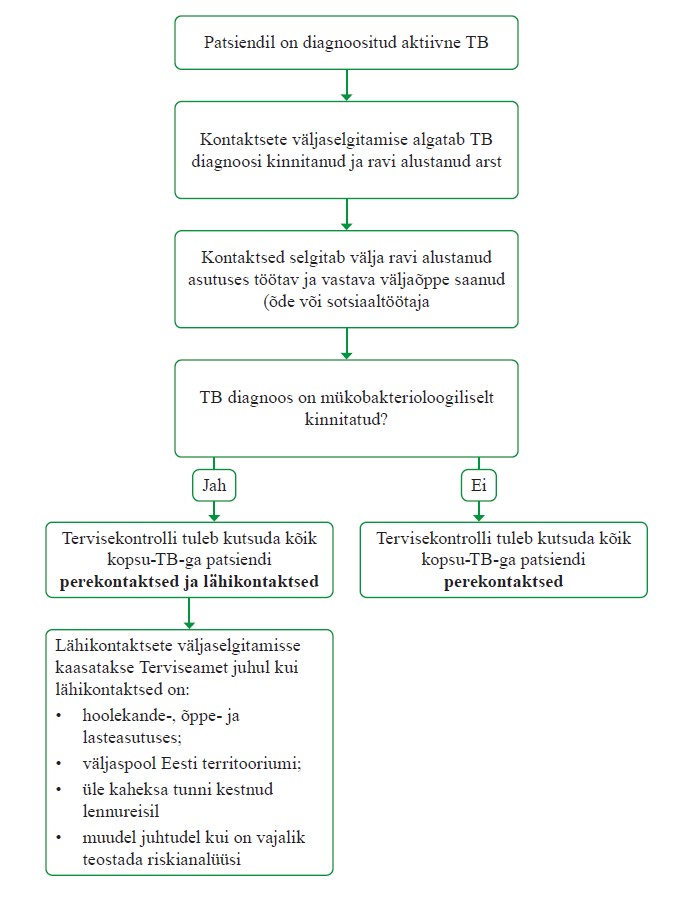
Lisa 10. Maailma Terviseorganisatsiooni soovitatavad raviskeemid latentse tuberkuloosi korral
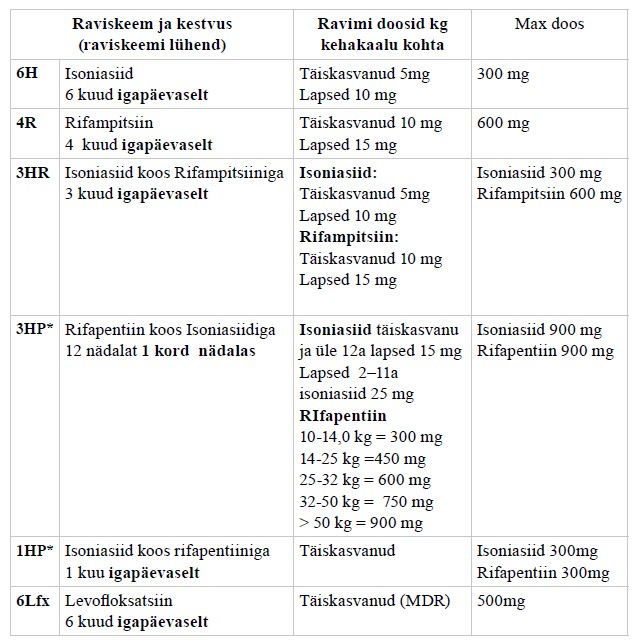
*enne ravi alustamist vaata WHO juhendist kasutamise tingimusi, vastunäidustusi ja ravimite koos- toimeid, kui patsient saab ARV-ravi
Kasutatud kirjandus
2. Tervise Arengu Instituut. Tervisestatistika ja terviseuuringute andmebaas; https://statistika.tai.ee/pxweb/et/Andmebaas/ Andmebaas__02Haigestumus__03Tuberkuloos/TB40.px/.
3. World Health Organization and the European Centre for Disease, Prevention and Control. Tuberculosis surveillance and monitoring in Europe 2023-2021 data. WHO; 2023.
4. WHO consolidated guidelines on tuberculosis Module 1: prevention - tuberculosis preventive treatment, second edition. WHO; 2024.
5. WHO consolidated guidelines on tuberculosis: module 2: screening: systematic screening for tuberculosis disease. WHO; 2021.
6. WHO consolidated guidelines on tuberculosis. Module 3: Diagnosis – rapid diagnostics for tuberculosis detection 2021 update. WHO; 2021.
7. Canadian Tuberculosis Standards - 8th Edition. Can J Respir Crit Care Sleep Med; 2022.
8. Guidelines for Programmatic Management of TB Preventive Treatment in India 2021. Ministry of Health and Family Welfare Government of India; 2021.
9. Management of Tuberculosis (4rd Edition). Malaysia Health Technology Assessment Section, Ministry of Health Malaysia; 2021.
10. TB CARE I. International Standards for Tuberculosis Care, Edition 3. TB CARE I; 2014.
11. Global Tuberculosis Report 2016. WHO; 2016.
12. Landry J, Menzies D. Preventive chemotherapy. Where has it got us? Where to go next? Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis; 2008.
13. Ai J, Ruan Q, Liu Q, Zhang W. Updates on the risk factors for latent tuberculosis reactivation and their managements. Emerg Microbes Infect; 2016.
14. Lönnroth K, Williams B, Stadlin S, et al. Alcohol use as a risk factor for tuberculosis – a systematic review. BMC Public Health; 2008.
15. Lönnroth K, Gastro K, Chakaya J, et al. Tuberculosis control and elimination 2010–50: cure, care, and social development. Lancet; 2010.
16. Rehm J, Samokhvalov A, Neuman M, et al. The association between alcohol use, alcohol use disorders and tuberculosis (TB). A systematic review. BMC Public Health; 2009.
17. TB risk factors. Centers for Disease Control and Prevention; https://www.cdc. gov/tb/topic/basics/risk.htm.
18. Tuberculosis. NICE; 2016.
19. Piccazzo R, Paparo F, Garlaschi G. Diagnostic accuracy of chest radiography for the diagnosis of tuberculosis (TB) and its role in the detection of latent TB infection: a systematic review. J Rheumatol Suppl; 2014.
20. Cain K, McCarthy K, Heilig C, et al. An algorithm for tuberculosis screening and diagnosis in people with HIV. N Engl J Med; 2010.
21. Swindells S, Komarow L, Tripathy S, et al. Screening for pulmonary tuberculosis in HIV-infected individuals: AIDS Clinical Trials Group Protocol A5253. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis; 2013.
22. Metcalfe J, Everett C, Steingart K, et al. Interferon-γ release assays for active pulmonary tuberculosis diagnosis in adults in low- and middle-income countries: systematic review and meta-analysis. J Infect Dis; 2011.
23. Sester M, Sotgiu G, Lange C, et al. Interferon-γ release assays for the diagnosis of active tuberculosis: a systematic review and meta-analysis. Eur Respir J; 2011.
24. Santin M, Muñoz L, Rigau D. Interferon-γ release assays for the diagnosis of tuberculosis and tuberculosis infection in HIV-infected adults: a systematic review and meta-analysis. Plos One; 2012.
25. Sandgren A, Hollo V, van der Werf MJ. Extrapulmonary tuberculosis in the European Union and European Economic Area, 2002 to 2011. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull; 2013.
26. Viiklepp P, Hollo V, Villand K. Tuberkuloosihaigestumus Eestis 2014–2019. Tervise Arengu Instituut; 2021.
27. Iseman MD. A Clinician’s Guide to Tuberculosis. Lippincott, Williams & Wilkins; 2020.
28. Boachie-Adjei O, Squillante RG. Tuberculosis of the spine. Orthop Clin North Am; 1996.
29. Pertuiset E, Beaudreuil J, Lioté F, et al. Spinal tuberculosis in adults. A study of 103 cases in a developed country, 1980-1994. Medicine (Baltimore); 1999.
30. Sanghvi D A, Iyer V R, Deshmukh T, Hoskote SS. MRI features of tuberculosis of the knee. Skeletal Radiol; 2009.
31. Sawlani V, Chandra T, Mishra RN, et al. MRI features of tuberculosis of peripheral joints. Clin Radiol; 2003.
32. Eastwood JB, Corbishley CM, Grange JM. Tuberculosis and the kidney. J Am Soc Nephrol JASN; 2001.
33. Hsu HL, Lai CC, Yu MC, et al. Clinical and microbiological characteristics of urine culture-confirmed genitourinary tuberculosis at medical centers in Taiwan from 1995 to 2007. Eur J Clin Microbiol Infect Dis Off Publ Eur Soc Clin Microbiol; 2011.
34. Webster D, Long R, Shandro C, et al. Fluoroquinolone resistance in renal isolates of Mycobacterium tuberculosis. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis; 2010.
35. Debi U, Ravisankar V, Prasad KK, Sinha SK, Sharma AK. Abdominal tuberculosis of the gastrointestinal tract: revisited. World J Gastroenterol; 2014.
36. Almadi MA, Ghosh S, Aljebreen AM. Differentiating intestinal tuberculosis from Crohn’s disease: a diagnostic challenge. Am J Gastroenterol; 2009.
37. Lee WK, Van Tonder F, Tartaglia CJ, et al. CT appearances of abdominal tuberculosis. Clin Radiol; 2012.
38. Lin PY, Wang JY, Hsueh PR, et al. Lower gastrointestinal tract tuberculosis: an important but neglected disease. Int J Colorectal Dis; 2009.
39. Davis JL, Cattamanchi A, Cuevas LE, Hopewell PC, Steingart KR. Diagnostic accuracy of same-day microscopy versus standard microscopy for pulmonary tuberculosis: a systematic review and meta-analysis. Lancet Infect Dis; 2013.
40. Monkongdee P, McCarthy KD, Cain KP, et al. Yield of acid-fast smear and mycobacterial culture for tuberculosis diagnosis in people with human immunodeficiency virus. Am J Respir Crit Care Med; 2009.
41. Horne DJ, Kohli M, Zifodya JS, et al. Xpert MTB/RIF and Xpert MTB/RIF Ultra for pulmonary tuberculosis and rifampicin resistance in adults. Cochrane Database Syst Rev; 2019.
42. Kohli M, Schiller I, Dendukuri N, et al. Xpert® MTB/RIF assay for extrapulmonary tuberculosis and rifampicin resistance. Cochrane Database Syst Rev; 2018.
43. Hang M, Xue M, He JQ. Diagnostic accuracy of the new Xpert MTB/RIF Ultra for tuberculosis disease: A preliminary systematic review and meta-analysis. Int J Infect Dis; 2020.
44. Nathavitharana RR, Cudahy PGT, Schumacher SG et al. Accuracy of line probe assays for the diagnosis of pulmonary and multidrug-resistant tuberculosis: a systematic review and meta-analysis. Eur Respir J; 2017.
45. Theron G, Peter J, Richardson M et al. GenoType(®) MTBDRsl assay for resistance to second-line anti-tuberculosis drugs. Cochrane Database Syst Rev; 2016.
46. Saderi L, Puci M, Lorenzo BD, et al. Rapid Diagnosis of XDR and Pre-XDR TB: A Systematic Review of Available Tools. Arch Bronconeumol; 2022.
47. Lee J H, Garg T, Lee J, et al. Impact of molecular diagnostic tests on diagnostic and treatment delays in tuberculosis: a systematic review and meta-analysis. BMC Infect Dis; 2022.
48. The use of molecular line probe assays for the detection of resistance to second- line anti-tuberculosis drugs. Policy guidance. World Health Organization; 2016.
49. Boyd R, Ford N, Padgen P, Cox H. Time to treatment for rifampicin-resistant tuberculosis: systematic review and meta-analysis. Int J Tuberc Lung Dis; 2017.
50. Bassili A, Fitzpatrick C, Qadeer E, Fatima R, Floyd K, Jaramillo EA. systematic review of the effectiveness of hospital- and ambulatory-based management of multidrug-resistant tuberculosis. Am J Trop Med Hyg; 2013.
51. Simonovska L, Ilievska-Popovsk B. Comparison of Results from Inpatient and Outpatient Treatment of Tuberculosis in Republic of Macedonia. Open Access Maced J Med Sci; 2015.
52. Narita M, Alonso P, Lauzardo M, Hollender ES, Pitchenik AE. Treatment experience of multidrug-resistant tuberculosis in Florida, 1994-1997. Chest; 2001.
53. Nakkushaiguste ennetamise ja tõrje seadus. Riigi Teataja; https://www. riigiteataja.ee/akt/111032023072.
54. Horne DJ, Royce SE, Gooze L, et al. Sputum monitoring during tuberculosis treatment for predicting outcome: systematic review and meta-analysis. Lancet Infect Dis; 2010.
55. Kurbatova EV, Gammino VM, Bayona J, et al. Frequency and type of microbiological monitoring of multidrug-resistant tuberculosis treatment. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis; 2011.
56. Dinnes J, Deeks J, Kunst H, et al. A systematic review of rapid diagnostic tests for the detection of tuberculosis infection. Health Technol Assess Winch Engl; 2007.
57. Chihota VN, Grant AD, Fielding K, et al. Liquid vs. solid culture for tuberculosis: performance and cost in a resource-constrained setting; 2010.
58. Thomas A, Gopi PG, Santha T, et al. Predictors of relapse among pulmonary tuberculosis patients treated in a DOTS programme in South India. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis; 2005.
59. Millet JP, Shaw E, Orcau À, et al. Tuberculosis Recurrence after Completion Treatment in a European City: Reinfection or Relapse? Plos One; 2013.
60. Nakkushaiguste ennetamise ja tõrje seadus. Riigi Teataja; https://www. riigiteataja.ee/akt/117052020007?leiaKehtiv.
61. Velen K, Shingde RV, Ho J, Fox GJ. The effectiveness of contact investigation among contacts of tuberculosis patients: a systematic review and meta-analysis. Eur Respir J; 2021.
62. Du Y, He Y, Zhang H, et al. Declining incidence rate of tuberculosis among close contacts in five years post-exposure: a systematic review and meta- analysis. BMC Infect Dis; 2023.
63. Siddalingaiah N, Chawla K, Nagaraja SB, Hazra D. Risk factors for the development of tuberculosis among the pediatric population: a systematic review and meta-analysis. Eur J Pediatr; 2023.
64. Schepisi MS, Motta I, Dore S, et al. Tuberculosis transmission among children and adolescents in schools and other congregate settings: a systematic review. New Microbiol; 2019.
65. Bao H, Liu K, Wu Z, et al. Tuberculosis outbreaks among students in mainland China: a systematic review and meta-analysis. BMC Infect Dis; 2019.
66. Maynard-Smith L, Brown CS, Harri RJ, et al. Effectiveness and outcomes of air travel-related TB incident follow-up: a systematic review. Eur Respir J; 2021.
67. WHO consolidated guidelines on tuberculosis: tuberculosis preventive treatment. Geneva: World Health Organization; 2020.
68. WHO consolidated guidelines on tuberculosis. Module 3: diagnosis. Tests for TB infection. Web Annex H. Use of tuberculin skin test or interferon gamma release assays for identifying individuals at greatest risk of progression to active TB. Geneva: WHO; 2022.
69. Jonas DE, Riley S, Lee L, et al. Screening for Latent Tuberculosis Infection in Adults: An Evidence Review for the U.S. Preventive Services Task Force. JAMA; 2023.
70. WHO consolidated guidelines on tuberculosis. Module 2: screening – systematic screening for tuberculosis disease. Web Annex B. GRADE summary of findings tables. WHO; 2021.
71. Dwilow R, Hui C, Kakkar F, Kitai I. Canadian Tuberculosis Standards - 8th Edition. Chapter 9: Pediatric tuberculosis. Canadian Journal of Respiratory, Critical Care, and Sleep Medicine; 2022.
72. Zunza M, Gray DM, Young T, Cotton M, Zar HJ. Isoniazid for preventing tuberculosis in HIV-infected children. Cochrane Database of Systematic Reviews; 2017.
73. Martinez L, Cords O, Horsburgh CR, et al. The risk of tuberculosis in children after close exposure: a systematic review and individual-participant meta- analysis. Lancet; 2020.
74. Padmapriyadarsini C, Das M, Burugina Nagaraja S, et al. Is chemoprophylaxis for child contacts of drug-resistant TB patients beneficial? A systematic review. Tuberc Res Treat; 2018.
75. Fox GJ, Barry SE, Britton WJ, Marks GB. Contact investigation for tuberculosis: a systematic review and meta-analysis. Eur Respir J; 2013.
76. Ai JW, Zhang S, Ruan QL, et al. The Risk of Tuberculosis in Patients with Rheumatoid Arthritis Treated with Tumor Necrosis Factor-α Antagonist: A Metaanalysis of Both Randomized Controlled Trials and Registry/Cohort Studies. J Rheumatol; 2015.
77. Jeon CY, Murray MB. Diabetes mellitus increases the risk of active tuberculosis: a systematic review of 13 observational studies. Plos Med; 2008.
78. Ayieko J, Abuogi L, Simchowitz B, et al. Efficacy of isoniazid prophylactic therapy in prevention of tuberculosis in children: a meta-analysis. BMC Infect Dis; 2014.
79. Hosford JD, von Fricken ME, Lauzardo M, et al. Hepatotoxicity from antituberculous therapy in the elderly: a systematic review. Tuberc Edinb Scotl; 2015.
80. Smith BM, Schwartzman K, Bartlett G, Menzies D. Adverse events associated with treatment of latent tuberculosis in the general population. CMAJ; 2011.
81. Marks SM, Mase SR, Morris SB. Systematic Review, Meta-analysis, and Cost-effectiveness of Treatment of Latent Tuberculosis to Reduce Progression to Multidrug-Resistant Tuberculosis. Clin Infect Dis; 2017.
82. WHO consolidated guidelines on tuberculosis. Module 4: Treatment. Tuberculosis care and support. WHO; 2022.
83. Cegielski J, Arab L, Cornoni-Huntley J. Nutritional risk factors for tuberculosis among adults in the United States. Am J Epidemiol; 2012.
84. Lönnroth K, Williams BG, Cegielski P, Dye C. A consistent log-linear relationship between tuberculosis incidence and body mass index. Int J Epidemiol; 2010.
85. Sinha P, Mehta S. Sinha P, Mehta S. Food: the tuberculosis vaccine we already have Lancet. 2023 Aug 19;402 (10402):588-590. Lancet; 2023.
86. Tuberculosis and air travel. Guidelines for prevention and control. 3rd edition. WHO; 2013.